Уран принадлежит к числу редких элементов. Однако в земной коре его 2•10-4%, т. е. больше, чем кадмия, серебра, ртути и висмута. Известно около 200 минералов урана, большинство из них — оксиды переменного состава или сложные уранаты (например, карнотит К2О•2UO3•V2O5•3Н2О, названный в честь французского горного инженера М. А. Карно). Небольшое количество урана содержится также во фторапатите Са5(РО4)3(ОН, F), монаците, некоторых глинах и сортах гранита. Простейший минерал — уранинит UO2+x, Это диоксид урана, подвергшийся частичному окислению кислородом воздуха либо кислородом, выделившимся в результате перестройки структуры оксида UO2 при радиоактивном превращении урана в свинец: при этом образуется оксид PbО, а избыточный кислород, выделяющийся в свободном виде, окисляет уран. Урановая руда считается богатой, если содержит от 0,5 до 1% урана. На заводах по переработке урановых руд уранинит обогащают, а затем отделяют уран от примесей и выделяют в виде оксида UO2.
Для получения металлического урана диоксид переводят в тетрафторид: UO2+4HF=UF4+2H2O и потом восстанавливают металлотёрмически: UF4+2Mg®t°U+2MgF2. Возникает вопрос: зачем надо превращать оксид во фторид, если уран можно получать и напрямую из оксида, восстанавливая его кальцием или магнием? Восстановление из фторида предпочтительнее, потому что только в этом случае выделяющегося в ходе реакции тепла достаточно для расплавления и металла, и шлака. Когда расплав охлаждают, образуется слиток урана. А при восстановлении оксида уран получается в виде порошка, который трудно отделить от шлака.
Актиниды — тугоплавкие металлы серебристого цвета. Как и 4f-элементы, они обладают высокой химической активностью. Однако, по сравнению с лантанидами, между отдельными представителями семейства актинидов различий больше: у каждого из них свои особенности. Из всех представителей семейства наибольшее практическое значение имеет уран. Одно время, на заре ядерных исследований, XX век называли даже веком урана.
По внешнему виду уран напоминает сталь: легко поддаётся ковке, полировке, прокатке, тугоплавок (tпл=1130 °С). Уран — плохой проводник тепла и электричества: его теплопроводность в 13 раз меньше теплопроводности меди.
Трансурановыми называют элементы, расположенные в периодической системе за ураном, т. е. имеющие порядковый номер больше 92.
В отличие от лантанидов, все 5f-элементы радиоактивны, т. е. не имеют стабильных изотопов. И если для тория и урана существуют изотопы, период полураспада которых измеряется миллиардами лет, то время жизни трансурановых, т. е. следующих за ураном, элементов, как правило, уменьшается с увеличением порядкового номера. Очевидно, что если элемент живёт лишь доли секунды,
это создаёт значительные трудности в изучении его химических свойств.
Из всего семейства актинидов в природе в заметном количестве встречаются лишь торий и уран, находящиеся в начале ряда. Остальные элементы являются искусственными, синтезированными человеком. Одни из трансурановых элементов выделены в количествах сотен тонн (Pu), для других массы исчисляются граммами или даже микрограммами, а некоторые получены лишь в количестве нескольких атомов.
Оксид урана U3O8, выделенный в 1789 г. немецким химиком Мартином Клапротом из урановой смоляной руды (урановой смолки), долгое время считали простым веществом. Ему присвоили имя планеты, открытой за восемь лет до этого.
Металлический уран впервые удалось получить в 1841 г. французскому учёному Эжену Пелиго (1811 — 1890) восстановлением тетрахлорида урана калием: UCl4+4К=U+4КCl. Аналогичным образом Берцелиусом в 1828 г. был получен торий, названный в честь Тора — бога-громовержца в скандинавской мифологии.
Сейчас трудно представить нашу жизнь без электричества. Однако ещё не так давно к фонарям на улицах тянулись не провода или электрические кабели, а трубы с газом. Газовое освещение появилось в начале XIX в. Светильный газ получали перегонкой каменного угля или древесины без доступа воздуха, и подобное производство являлось мощной отраслью промышленности.
Вообще-то сам по себе горящий газ даёт мало света. Резко увеличить освещённость горелки можно, поместив в пламя подходящее вещество, которое, разогреваясь, начинает само светиться. Вначале таким усилителем, «рабочим телом» служила платиновая проволока, но подобные горелки были очень дороги.
Настоящую революцию в осветительном деле совершил австрийский химик Карл Ауэр (1858—1929). Кстати, основные его исследования посвящены изучению редкоземельных элементов. Работая в лаборатории немецкого химика Роберта Бунзена, Ауэр заметил: если тугоплавкие оксиды редкоземельных элементов нагреть в пламени горелки, они начинают ярко светиться. Учёный начал интенсивно работать над усовершенствованием газовой горелки.
В старых учебниках по химии можно найти любопытное упоминание о церии — металле, который обладает удивительным свойством: если проволоку из него поскрести ножом, то образующиеся при этом мельчайшие пылинки самовоспламеняются на воздухе (такое свойство металла называется пирофорностью — от греч. «пир» — «огонь» и «форос» — «несущий»). Если же внести в пламя саму цериевую проволоку, она вспыхивает ослепительным огнём, превосходя по яркости горящий магний.
Необычное свойство церия использовал австрийский химик Карл Ауэр фон Вельсбах, разработав состав для «кремнёвых» зажигалок. В его основе — сплав церия с другими редкоземельными металлами (мишметалл — от нем. mischen— «смешивать»), образующийся при восстановлении смеси их оксидов кальцием. Небольшой кусочек подобного вещества при ударе (или энергичном трении о стальное колесико) даёт множество искр, которые легко поджигают фитиль. Для кремней зажигалок оптимален такой состав: Ce — 66%, Fe — 25%, La — 8%, Mg — 0,5%, Cu — 0,5%. Зажигалки позволили сэкономить огромное количество спичек.
Аналогичный сплав на основе церия используется также в трассирующих (светящихся) пулях и снарядах. Специальная насадка из пирофорного сплава надета на снаряд снаружи, а роль колёсика в зажигалке, высекающего искру, здесь играет воздух. При больших скоростях трение насадки о воздух заставляет снаряд искрить, в результате чего ночью легко проследить его путь к цели.
Оксиды некоторых лантанидов используют как катализаторы крекинга нефти (см. статью «Нефть. Метаморфозы»), а также для окраски стёкол: добавка оксида неодима придаёт стеклу фиолетовый оттенок, эрбия — розовый, празеодима — зелёный, церия (IV) — жёлтый. Соединения на основе сульфидов (Ln2S3) и оксисульфидов (Ln2O2S) редкоземельных элементов служат люминофорами в экранах цветных телевизоров и дисплеях компьютеров. В галогенные лампы вводят люминофоры на основе иодидов лантанидов. Они дают люминесцентное свечение разных цветов. Лантан и лантаниды — тугоплавкие металлы серебристо-белого цвета
Наиболее сильно ферромагнитные свойства выражены не у индивидуальных простых веществ, а у сплавов лантанидов с ферромагнитными металлами. При сплавлении металлов иногда образуются химические соединения — интерметаллиды. Примером может служить SmCo5. На основе этого и подобных ему соединений в наше время изготовлены наиболее мощные постоянные магниты: сравнительно небольшой магнит, который умещается на ладони, способен удержать легковой автомобиль вместе с пассажирами!
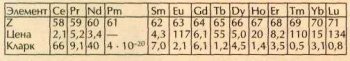
Так как у лантанидов наружные электронные оболочки построены одинаково, их химические свойства весьма сходны. Казалось бы, и встречаться в природе, и цениться они должны тоже одинаково. Однако таблица цен и распространённости лантанидов показывает, что это не так:
Во второй строке таблицы приведён порядковый номер элемента Z, в третьей — округлённая цена в долларах за 1 г металла в слитке чистотой 99,9 % (в ценах 2000 г. компании «Олдрич»). В графе прометия стоит прочерк: у этого элемента нет стабильных изотопов, один из самых долгоживущих — прометий-147 (период полураспада 2,62 года) — получают искусственно и используют в миниатюрных атомных батарейках. В 1998 г. 1 г 147Pm стоил примерно 10 млрд. долларов. Конечно, никто прометий граммами (и даже микрограммами) не покупает: его количество измеряют единицами активности — беккерелями и мегабеккерелями; для 147Pm 1МБк соответствует 3•10-9 г прометия.
Сплавы некоторых редкоземельных элементов с переходными металлами (например, LaNi5) способны поглотить в 1,5 — 2 раза больше водорода, чем его содержится в таком же объёме жидкого водорода. Это объясняется тем, что, попадая в пустоты кристаллической решётки металла, молекулы водорода распадаются на атомы, образующие связи с атомами металлов. А при незначительном нагревании сплав, насыщенный водородом, легко его отдаёт. На основе LaNi5 уже разработаны аккумуляторы водорода, которые могут использоваться при развитии водородной энергетики.
В 1794 г. Юхан Гадолин (1760—1852) (в честь него назван элемент гадолиний) из университета города Або в Финляндии выделил из редкого минерала (теперь он именуется гадолинитом), найденного в местечке Иттербю близ Стокгольма, новую землю, которую назвал иттриевой. В 1803 г. из другого минерала Якоб Берцелиус и Вильгельм Хизингер, а также Мартин Клапрот (независимо от первых двух) получили цериевую землю, названную по имени малой планеты Цереры, открытой незадолго до этого.
Потребовалось ещё несколько десятилетий, чтобы доказать, что эти земли неоднородны, т. е. не являются индивидуальными соединениями. Так, в 1839—1841 гг. шведский химик Карл Густав Мосандер (1797—1858) выделил из цериевой земли две новые — лантановую (от греч. «лантано» — «скрываюсь») и дидимовую (от греч. «дидимаон» — «близнецы»).
Лантаниды относят к редким элементам: их содержание в земной коре не превышает по массе 0,01%. Однако 0,01% — не так уж мало. Например, атомов церия — наиболее распространённого из лантанидов — в природе содержится в пять раз больше, чем атомов свинца, а тулия — самого редкого из членов этого семейства — больше, чем иода. Единственное исключение — прометий, у которого нет стабильных изотопов, и потому он в природе практически не встречается.
В литературе нередко используется также термин редкоземельные элементы. Под ним понимают группу из 17 элементов, включающую трёх представителей побочной подгруппы третьей группы — скандий Sc, иттрий Y, лантан La и 14 лантанидов (общий символ — Ln). Термин этот исторический. Раньше землями называли тугоплавкие оксиды многих элементов (магния, кальция, бария, алюминия и др.). Название «редкие земли» закрепилось первоначально за оксидами иттрия и церия, а затем было распространено и на другие близкие по свойствам элементы.
Один из важнейших минералов лантанидов — монацит (Y, La, Ln)PO4 — содержит сразу все или почти все лантаниды, но в разном соотношении, а также иттрий и лантан. Название минерала происходит от греческого «моназо» — «уединяюсь», «обособляюсь», ведь монацит встречается обычно в виде отдельных зёрен. Из-за присутствия тория, а также следов других радиоактивных элементов монацитовая руда (монацитовый песок) радиоактивна.
Близкие значения ионных радиусов и очень похожие химические свойства делают лантаниды настолько сходными, что долгое время их не удавалось разделить.
При взгляде на таблицу Менделеева невольно возникает вопрос: почему некоторые элементы помещены не в самой таблице, а как бы вынесены за её пределы? Что это — знак особой чести, уважения или, наоборот, свидетельство пренебрежительного отношения к ним: мол, хватит вам одной клетки в самой периодической системе? К тому же и называют их в разных таблицах по-разному: то лантаноидами и актиноидами, то лантанидами и актинидами...
Есть у них ещё одно общее название: и лантаниды, и актиниды — это f-элементы, поскольку в их атомах достраивается внутренняя электронная f-оболочка. Всего на ней может разместиться не более 14 электронов; ровно столько же и наших героев — лантанидов (иначе 4f-элементов) и актинидов (5f-элементов).
Лантаниды расположены в периодической системе после лантана, актиниды — после актиния. Их отсутствие (в явном виде) в III группе таблицы отмечено звёздочками у символов La и Ас.
Окрашенные соли лантанидов.
Ртутное месторождение Монте-Амьята в Италии разрабатывается со времён Древнего Рима. Причина столь ранней известности ртути в том, что добываемая там киноварь (сульфид ртути HgS) легко разлагается при нагревании на воздухе с образованием паров металлической ртути:
В древности обжиг киновари проводили в закрытом глиняном сосуде, на крышке которого конденсировалась ртуть. Сейчас для этих целей используют трубчатые печи.
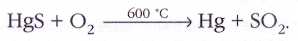
Ртуть (tкип=357 °С) — самая тяжёлая из всех известных жидкостей: