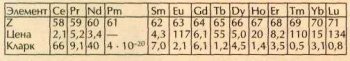
Так как у лантанидов наружные электронные оболочки построены одинаково, их химические свойства весьма сходны. Казалось бы, и встречаться в природе, и цениться они должны тоже одинаково. Однако таблица цен и распространённости лантанидов показывает, что это не так:
Во второй строке таблицы приведён порядковый номер элемента Z, в третьей — округлённая цена в долларах за 1 г металла в слитке чистотой 99,9 % (в ценах 2000 г. компании «Олдрич»). В графе прометия стоит прочерк: у этого элемента нет стабильных изотопов, один из самых долгоживущих — прометий-147 (период полураспада 2,62 года) — получают искусственно и используют в миниатюрных атомных батарейках. В 1998 г. 1 г 147Pm стоил примерно 10 млрд. долларов. Конечно, никто прометий граммами (и даже микрограммами) не покупает: его количество измеряют единицами активности — беккерелями и мегабеккерелями; для 147Pm 1МБк соответствует 3•10-9 г прометия.
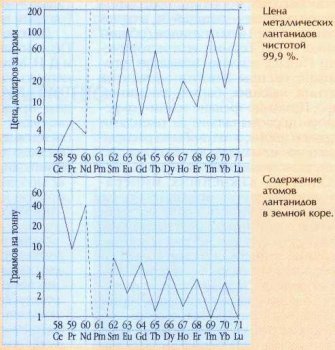
Как следует из таблицы, нечётные элементы дороже чётных. Особенно наглядно это видно на графике (верхняя «пила»). Подобная зависимость объясняется тем, что нечётные лантаниды встречаются в минералах, из которых их добывают, реже, чем чётные. Это — почти универсальное правило. ещё в 1914 г. итальянский учёный Джузеппе Оддо (1865—1954), а в 1917 г. американец Уильям Дрепер Харкинс (1873—1951) обратили внимание на то, что чётные элементы вообще преобладают в природе — их почти 90 %. Чётные номера имеют и самые распространённые в земной коре элементы — кислород и кремний, на долю которых приходится три четверти её массы.
Содержание лантанидов в земной коре (в граммах на тонну) приведено в последней строке таблицы (и на нижнем графике). Эти значения (часто их выражают также в массовых процентах) называются кларками — в честь американского геохимика Франка Уиглсуорта Кларка (1847-— 1931), который в 1889 г. впервые попытался оценить содержание известных тогда химических элементов в земной коре. Видно, что кларки лантанидов также образуют «пилу», причём её зубья, в отличие от тех, что на графике цен, попадают на чётные элементы. Получается так, конечно, не случайно. Порядковый номер элемента определяется числом протонов в ядре. Однако дело не только в них — это следует, например, из таблицы распространённости в природе стабильных изотопов неодима (все они имеют одинаковое число протонов):
Значит, надо учитывать «чётность» не только протонов, но и нейтронов в ядрах элементов.
Обратимся теперь к таблице, в которой собраны данные для стабильных нуклидов всех элементов, содержащихся в земной коре (их известно около 300). В ней приведено содержание нуклидов каждого типа (исключая кислород, на который приходится 52 %).
Выходит, что распространённость в природе зависит прежде всего от чётности нейтронов. Если подсчитать их в ядрах самых распространённых лантанидов с чётным числом протонов, то окажется, что и число нейтронов у них чётное. Так, церий-140 (82 нейтрона) составляет 88,5% всего природного церия, изотопов неодима с чётным числом нейтронов — 79,5%, эрбия — 77% и т. д.
Исчерпывающего объяснения причин всех этих проявлений «чётно-нечётного эффекта» пока нет. Можно лишь привести мнение по этому поводу американского писателя-фантаста (и биохимика) Айзека Азимова: «Почти 87 процентов земной коры состоит из элементов с чётными атомными номерами. А если взять весь земной шар, то этот процент ещё увеличится... Мне думается, что наш земной шар на 96 процентов „чёт/чёт". Это, пожалуй, безобразие. Как давний энтузиаст научной фантастики и активный противник существующего порядка вещей, я всегда питал необъяснимую симпатию к „нечет/нечету" в той же мере, как и ко всему необычному».


Похожие статьи