Ртутное месторождение Монте-Амьята в Италии разрабатывается со времён Древнего Рима. Причина столь ранней известности ртути в том, что добываемая там киноварь (сульфид ртути HgS) легко разлагается при нагревании на воздухе с образованием паров металлической ртути:
В древности обжиг киновари проводили в закрытом глиняном сосуде, на крышке которого конденсировалась ртуть. Сейчас для этих целей используют трубчатые печи.
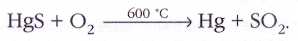
Ртуть (tкип=357 °С) — самая тяжёлая из всех известных жидкостей:
Металлическая ртуть.
литр её при 20 °С весит 13,6 кг. Обычная стеклянная банка под тяжестью ртути может не выдержать и расколоться. Поэтому большие количества ртути хранят в специальных толстостенных стеклянных сосудах либо в железных ёмкостях. Низкая температура плавления ртути (-39 °С) объясняется тем, что атомы Hg прочно удерживают свои валентные электроны и с трудом предоставляют их в «общее пользование». Таким образом, кристаллическая решётка ртути оказывается неустойчивой. Кстати, поэтому ртуть плохо проводит тепло и электрический ток.
Многие металлы (натрий, цинк кадмий и другие) хорошо растворяются в ртути с образованием амальгам — жидких или твёрдых сплавов. Раньше этим свойством ртути пользовались для получения зеркал путем нанесения на стекло амальгамы олова. Способность ртути растворять натрий и калий используют при электролитическом получении щелочей.
Жидкая ртуть равномерно расширяется при нагревании, поэтому ею заполняют термометры.
Ртуть, в отличие от своих соседей по подгруппе, — малоактивный металл. Растворить её можно в царской водке или концентрированной азотной кислоте:
Hg+4HNO3=Hg(NO3)2+2NO2+2H2O.
Почти все металлы, кроме золота, серебра и платины, способны вытеснять ртуть из растворов её солей. Если медную или бронзовую монету
Миний (киноварь. — Прим. ред)... кладут в железном раковинообразном сосуде на глиняные блюда, покрывают его чашей и замазывают сверху глиной, затем разводят под блюдом огонь, непрерывно поддерживая его мехами, и, наконец, снимают с чаши испарину, которая получается цвета серебра и жидкой, как вода.
Плиний Старший. «Естественная история»

«Волк, пожирающий царя» — аллегория, отражающая способность ртути растворять золото. Раскрашенная гравюра. XVII в.
натереть нитратом ртути, то она покроется слоем ртути и приобретёт яркий серебристый блеск. Однако мы не советуем проводить этот опыт, ведь все соединения ртути сильно ядовиты.
Одно из широко используемых соединений ртути — фульминат Hg(CNO)2, соль гремучей кислоты HCNO. Его называют также гремучей ртутью. При ударе фульминат легко детонирует:
поэтому его используют в капсюлях патронов и снарядов в качестве детонатора, взрыв которого приводит к воспламенению пороха.
Ртуть — единственный металл, способный образовывать устойчивый катион, состоящий из двух атомов, — Hg22+. Содержащие этот катион соединения ртути (I) можно получить взаимодействием металлической ртути с солью ртути(II):
Hg(NO3)2+Hg=Hg2(NO3)2.
В отличие от других металлов, ртуть образует преимущественно ко-
валентные связи. Так, например, хлорид ртути(II) HgCl2 в водном растворе существует преимущественно в виде молекул, такой раствор почти не проводит электрический ток. Зато это соединение растворяется в органических растворителях, а при 302 °С возгоняется (сублимируется). Недаром алхимики назвали его «сулема» (искажённое от «сублимат»).
Ртуть — один из немногих металлов, не образующих гидроксидов. Гидроксид ртути(II) уже при попытке его выделения отщепляет воду, превращаясь в оксид:
Hg(NO3)2+2NaOH=HgO¯+Н2О+2NaNO3.
А для ртути(I) не удалось получить даже оксида, так как он мгновенно распадается (диспропорционирует) на оксид ртути(II) и металлическую ртуть:
Hg2(NO3)2+2NaOH=HgO¯+Hg¯+H2O+2NaNO3.

«Мужчина и женщина» — сера и ртуть. С гравюры XVI в.
С6Н6+Hg(CH3OO)2=CH3COO—Hg—С6Н5+СН3СООН. Ртуть входит в десятку наиболее опасных ядов. Особенно токсичны соединения со связью С—Hg, например ион метилртути Н3C—Hg+. Любое неорганическое соединение ртути (II), попавшее в организм, под действием метилкобаламина (витамина В12) — вещества, отдающего СН3-группу, — превращается в ион метилртути. Все соединения метилртути растворимы в жирах и потому легко проникают через клеточные мембраны. Токсичность ртути объясняется тем, что она образует очень прочные связи с серой. Ионы ртути реагируют с сульфгидрильными (тиольными) группами белков, превращаясь в весьма устойчивые соединения — тиолаты: R—SH+Hg2+=R—S—Hg++Н+.
Сейчас во всех странах применение ртути стремятся ограничить, и её добыча неуклонно снижается. Так, в 1995 г. в мире было добыто не более 10 тыс. тонн ртути — в два раза меньше, чем двумя десятилетиями ранее

Похожие статьи