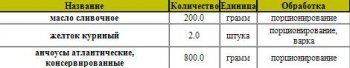
Блюдо: Жареное мясо и субпродукты
Суммарный вес: 140.8 г
Продуктовый состав:
Способ приготовления:
Антрекот нарезают из толстого или тонкого края по одному куску на порцию толщиной 15-20 мм, отбивают, посыпают солью и перцем и жарят основным способом. Отпускают антрекот с гарниром и строганым хреном, поливают мясным соком и кладут на него кусочек зеленого масла. При отсутствии свежего хрена к антрекоту отдельно можно подать соус хрен промышленного производства (30 г). Гарниры - картофель в молоке, картофель жареный (из вареного), картофель жареный (из сырого); картофель жаренный во фритюре, сложные гарниры
Питательные вещества, витамины, микроэлементы на 100 г:
Калорийность: 395.9 ккал
Вода: 117.9 г
Белки: 27.3 г
Жиры: 31.2 г
Углеводы: 1.7 г
Ненасыщеные жирные кислоты: 0.2 г
Холестерин: 3.1 мг
Моно- и дисахариды: 1.0 г
Крахмал: 0.6 г
Пищевые волокна: 1.1 г
Органические кислоты: 0.03 г
Зола: 1.8 г
Витамин A: 0.1 мг
Витамин B1: 0.08 мг
Витамин B2: 0.2 мг
Витамин B3: 0.6 мг
Витамин B6: 0.6 мг
Витамин B9: 16.4 мкг
Витамин B12: 3.5 мкг
Витамин C: 8.4 мг
Витамин D: 1.1 мкг
Витамин E: 1.0 мг
Витамин H: 3.7 мкг
Витамин PP: 3.9 мг
Холин: 84.9 мг
Железо: 3.9 мг
Калий: 361.5 мг
Кальций: 33.0 мг
Магний: 31.7 мг
Натрий: 80.2 мг
Сера: 274.8 мг
Фосфор: 283.6 мг
Хлор: 74.5 мг
Йод: 9.8 мкг
Кобальт: 9.6 мкг
Марганец: 45.2 мкг
Медь: 218.4 мкг
Молибден: 13.7 мкг
Никель: 10.3 мкг
Олово: 88.3 мкг
Фтор: 86.7 мкг
Хром: 11.5 мкг
Цинк: 3820.0 мкг
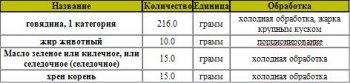
Блюдо: Тушеное мясо и субпродукты
Суммарный вес: 338.0 г
Способ приготовления:
Мясо, нарезанное брусочками по 10-15 г, обжаривают, заливают горячим бульоном или водой, добавляют пассерованное томатное пюре и тушат почти до готовности в закрытой посуде при слабом кипении На оставшемся бульоне приготавливают соус. в который кладут соленые огурцы нарезанные соломкой, пассерованный лук, перец, соль Полученным соусом заливают мясо, добавляют жареный картофель и тушат еще 15-20 мин. За 5-10 мин до готовности кладут свежие помидоры (I колонка), лавровый лист Готовое блюдо заправляют растертым чесноком. Блюдо можно готовить по I кол без помидоров, увеличив закладку картофеля на 45 г нетто. Для удобства порционирования картофель и помидоры можно тушить отдельно. Отпускают азу вместе с соусом и гарниром
Чтобы можно было сравнивать друг с другом химические связи, в том числе и связи разных типов, используют единые количественные характеристики, среди которых главные — длина, энергия, полярность и порядок связи.
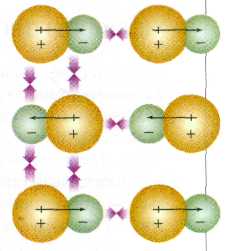
Дипольные взаимодействия в молекулярном кристалле.
Основных типов химических связей три — ковалентная, ионная и металлическая. Но иногда важную роль могут играть довольно слабые силы, действующие между молекулами. Этими силами в основном определяются температуры плавления и кипения веществ, а также некоторые их химические свойства.
Все молекулы электрически нейтральны. Однако во многих из них центры отрицательных и положительных зарядов находятся в разных местах. В таких случаях молекулу называют диполем. Полярные молекулы легко притягиваются друг к другу.
Правда, взаимодействие диполей относительно слабое: его энергия обратно пропорциональна шестой степени расстояния между центрами молекул Е~ 1/r6 (для сравнения: энергия кулоновского взаимодействия Е~1/r). Поэтому оно проявляется главным образом в твёрдом и жидком состояниях, когда расстояния между молекулами намного меньше, чем в газе. В твёрдом состоянии молекулярные диполи ориентированы так, что положительные полюса одних максимально приближены к отрицательным полюсам других.
Аля металлов характерен особый тип химической связи: валентные электроны всех атомов объединяются в так называемый электронный газ и свободно двигаются в кристаллической решётке, образованной ионами. Каждый электрон как бы принадлежит всем атомам одновременно, и кристалл металла можно рассматривать как одну гигантскую молекулу. В таких молекулах МО имеют особые свойства.
Рассмотрим кусок лития массой 1,17 г. Он содержит 1/6 моль лития, т. е. 1023 атомов, каждый из которых имеет наполовину заполненную валентную 2s-орбиталь. Все 1023 атомных орбиталей в молекуле превращаются в 1023 молекулярных орбиталей, энергия которых изменяется в пределах 100 кДж/моль, а сами орбитали распределены (делокализованы) по всей молекуле. Хорошая электрическая проводимость металлов объясняется тем, что разница в энергии между двумя соседними МО составляет ничтожно малую величину: 100/1023=10-21 кДж/моль. Поэтому электроны могут свободно переходить с орбитали на орбиталь при наличии внешнего электрического поля.
Понятие валентности в химии долго считалось одним из основных. «Валентность — фундаментальное свойство атома, — писал более века назад знаменитый немецкий учёный, один из создателей теории химического строения Фридрих Кекуле, — свойство такое же постоянное и неизменяемое, как и самый атомный вес». Однако в современной научной литературе этот термин употребляется не очень широко. Более того, даже в учебниках он трактуется по-разному.
Так, если валентность определять общим числом электронов, участвующих в образовании химических связей с другими атомами, то азот в HNO3 следует считать пятивалентным, поскольку его атом использовал все свои пять внешних электронов — два s-электрона (спаренные) и три р-электрона (неспаренные):
Если же валентность определять числом электронных пар, которыми данный атом связан с другими, то максимальная валентность азота будет равна четырём.
При этом три р-электрона образуют с электронами других атомов три ковалентные связи, а ещё одна образуется за счёт двух s-электронов. Пример — реакция аммиака с кислотами.
Наконец, если определять валентность только числом неспаренных электронов в атоме, то валентность азота не может превышать трёх, поскольку распаривание s-электронов невозможно — для этого у атома азота нет подходящих орбиталей. Например, в галогенидах азот образует только три ковалентные связи, и не существует таких соединений, как NCl5, или NBr5 (в отличие от вполне стабильных РСl5 и РВr5).
Электронная плотность создаётся всеми электронами в молекуле. Одни из них при образовании молекулы из атомов остаются практически неизменными, другие меняются очень сильно. Для понимания природы химической связи наиболее интересно поведение последних.
Для описания электронов в атоме используют понятие атомной орбитали (АО), которая характеризует вероятность нахождения электрона в каждой точке пространства (вне орбитали электронная плотность мала). То же справедливо и для молекул. Состояние каждого электрона в молекуле характеризуется понятием молекулярной орбитали (МО). Если известна форма МО, можно определить те места в молекуле, где электрон, находящийся на этой орбитали, бывает чаще всего.
Очень наглядное представление о химической связи даёт квантовая механика. Эта наука позволяет с высокой точностью рассчитать распределение электронов в молекуле. Функцию, которая описывает вероятность нахождения электронов в любой точке молекулы, называют электронной плотностью. Её измеряют в долях единицы, а для её изображения обычно используют поверхности равной плотности, т. е. выбирают какое-либо значение, например 0,002 или 0,08, и показывают все точки в пространстве, в которых электронная плотность принимает это значение (трёхмерное изображение). Есть и другой способ — выбрать какую-либо плоскость (сечение) и рассматривать значения электронной плотности только в этой плоскости (контурная карта).
Чем же хороша электронная плотность? Во-первых, она позволяет изобразить так называемое электронное облако молекулы. Поверхность с электронной плотностью 0,002 обычно сосредотачивает в себе больше 98% всей электронной плотности, поэтому она отражает размеры и форму электронного облака.
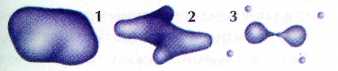
Поверхности равной электронной плотности молекулы этилена С2Н4: 1 — 0,002; 2 — 0,2; 3 — 0,36.
Рассмотрим образование простейшего молекулярного иона H+2; Н+Н+ ® H+2.
Сравним его энергию с энергией исходных частиц. Если исходные частицы Н и Н+ пребывают в состоянии покоя на большом расстоянии друг от друга, то общая энергия складывается из кинетической энергии электрона в атоме Н и потенциальной энергии его притяжения к ядру атома.
Если приблизить частицы Н и Н+ друг к другу, то появятся два новых источника энергии: электрон станет притягиваться также к чужому ядру, у которого нет своего электрона, а два ядра будут отталкиваться друг от друга. Первый процесс уменьшает общую энергию, второй — увеличивает её.
По мере сближения Н и Н+ общая энергия системы сначала уменьшается — до тех пор, пока притяжение электрона к чужому ядру играет главную роль. При расстоянии между ядрами 0,106 нм общая энергия системы становится минимальной. Дальнейшее сближение ядер приводит к их сильному отталкиванию и, как следствие, к значительному увеличению общей энергии.
Выигрыш в энергии по сравнению с изолированными частицами составляет 268 кДж/моль, причём основной вклад вносит притяжение электрона к чужому ядру. Это и есть энергия химической связи в молекуле.
Итак, главный результат образования химической связи — уменьшение общей энергии системы ядер и электронов, а достигается он путём совместного использования электронов разными ядрами. Тем самым подтверждается гениальная догадка Томсона о том, что главную роль в химической связи играют электроны.
Если сближать друг с другом два атома гелия (электронная конфигурация 1s2), общая энергия всё время повышается: при любом расстоянии она больше, чем сумма энергий изолированных атомов. Это означает, что молекула Не2 из таких атомов образоваться не может.
Если же один из атомов возбудить и перевести 1s-электрон на 2s-ypoвень, то такой атом способен соединиться с невозбуждённым во вполне устойчивую (с энергетической точки зрения) молекулу. Правда, молекула в возбуждённом состоянии живёт недолго: примерно через 10-8 секунд после образования она испустит квант света и перейдёт в основное состояние, в результате чего немедленно распадётся на атомы.
Молекулы, которые могут существовать только в возбуждённом состоянии, называют эксимерами (от лат. excito— «возбуждаю»). К ним относятся многие двухатомные молекулы, например Не2, Ne2, Ar2, XeF, KrF, Hg2. Энергия, выделяющаяся при электронных переходах в подобных молекулах, используется в мощных эксимерных лазерах, работающих в ультрафиолетовом и видимом диапазоне.
В 1957 г. канадский физикохимик Роналд Джеймс Гиллеспи создал простую, но красивую теорию, которая позволяет с хорошей точностью по структуре Льюиса предсказывать геометрическую форму молекул.
Согласно этой теории, во многих простых молекулах химические связи расположены таким образом, что электронные пары, принадлежащие одному атому, максимально удалены друг от друга.
Например, в молекуле ВеН2 атом бериллия делит с атомами водорода две пары электронов. Одна пара максимально удалена от другой, когда угол между связями составляет 180°. Это означает, что молекула линейна.
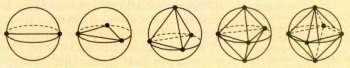
Теория даёт возможность установить геометрическое строение молекул типа AXnEm, где к центральному атому А присоединены n атомов X и имеется также т неподелённых электронных пар (что обозначено символом Еm). Общее число электронных пар m+n составляет от двух до восьми.
Чтобы определить максимально удалённое расположение электронных пар, можно представить каждую пару точечным зарядом на поверхности сферы, в центре которой находится атом, и найти максимум суммы расстояний между этими зарядами.
Расположение точек на поверхности сферы, при котором они максимально удалены друг от друга.