В 1957 г. канадский физикохимик Роналд Джеймс Гиллеспи создал простую, но красивую теорию, которая позволяет с хорошей точностью по структуре Льюиса предсказывать геометрическую форму молекул.
Согласно этой теории, во многих простых молекулах химические связи расположены таким образом, что электронные пары, принадлежащие одному атому, максимально удалены друг от друга.
Например, в молекуле ВеН2 атом бериллия делит с атомами водорода две пары электронов. Одна пара максимально удалена от другой, когда угол между связями составляет 180°. Это означает, что молекула линейна.
Теория даёт возможность установить геометрическое строение молекул типа AXnEm, где к центральному атому А присоединены n атомов X и имеется также т неподелённых электронных пар (что обозначено символом Еm). Общее число электронных пар m+n составляет от двух до восьми.
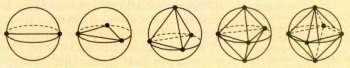
Чтобы определить максимально удалённое расположение электронных пар, можно представить каждую пару точечным зарядом на поверхности сферы, в центре которой находится атом, и найти максимум суммы расстояний между этими зарядами.
Расположение точек на поверхности сферы, при котором они максимально удалены друг от друга.
В оптимальной конфигурации ядер два заряда находятся на концах диаметра, три заряда образуют правильный треугольник, четыре — тетраэдр, шесть — октаэдр. Эти конфигурации можно сделать более наглядными, если представить электронные пары в виде связки воздушных шаров, как показано на рисунке.
Связки, содержащие от двух до шести шаров, максимально удалённых друг от друга
Рассмотрим молекулы с четырьмя электронными парами, находящимися в вершинах тетраэдра. В молекуле CF4 (тип АХ4) все пары принадлежат химическим связям, поэтому атомы фтора также расположены в вершинах тетраэдра. В молекуле NF3 (тип АХ3Е) одна пара электронов азота не участвует в образовании связи, так что молекула имеет форму треугольной пирамиды. Наконец, молекула F2O (тип АХ2Е2) с двумя неподеленными электронными парами имеет угловую форму.

Похожие статьи