Электронная плотность создаётся всеми электронами в молекуле. Одни из них при образовании молекулы из атомов остаются практически неизменными, другие меняются очень сильно. Для понимания природы химической связи наиболее интересно поведение последних.
Для описания электронов в атоме используют понятие атомной орбитали (АО), которая характеризует вероятность нахождения электрона в каждой точке пространства (вне орбитали электронная плотность мала). То же справедливо и для молекул. Состояние каждого электрона в молекуле характеризуется понятием молекулярной орбитали (МО). Если известна форма МО, можно определить те места в молекуле, где электрон, находящийся на этой орбитали, бывает чаще всего.
плотность сосредоточена между атомами, на разрыхляющей — за ними. Перекрываются s-орбитали всегда по линии, соединяющей ядра атомов. Возникающие при этом МО обозначают буквой s, а соответствующую химическую связь называют s-связью. У одинаковых атомов p-орбитали могут перекрываться как по линии, соединяющей ядра, так и вне этой линии. В последнем случае образующиеся МО обозначают буквой p, а такую химическую связь называют p-связью. Молекулярные орбитали гораздо чаще связывают разные атомы, чем одинаковые. При этом также образуются связывающие и разрыхляющие орбитали. Например, в молекуле HF две s-орбитали образуются при перекрывании 1s-орбитали атома Н и одной из 2р-орбиталей атома F. Два электрона (по одному от каждого атома) занимают связывающую орбиталь, а разрыхляющая орбиталь остаётся свободной. Остальные восемь электронов атома F не принимают участия в образовании химической связи. Мы изобразили только несколько простейших типов МО. Современные компьютеры позволяют рассчитывать МО и электронную плотность в сложных молекулах, содержащих десятки атомов. В них могут существовать орбитали, связывающие между собой несколько атомов. Такие орбитали называют многоцентровыми. А в металлах МО связывают сразу все атомы; химическая связь в них так и называется — металлическая.
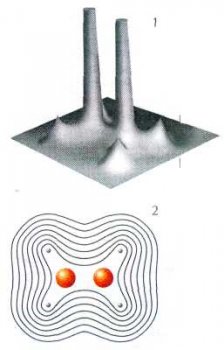
Значения электронной плотности молекулы этилена С2Н4 в плоскости, проходящей через ядра атомов углерода и водорода:
1 — трёхмерное изображение;
2 — контурная карта. Максимумы электронной плотности сосредоточены на атомах углерода и водорода.
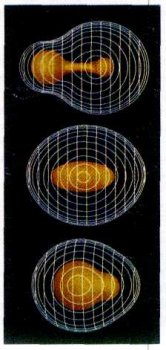
Поверхности равной электронной плотности молек
Электронные облака молекул метана СН4 и аммиака NH3. ул LiH, H2, HF.
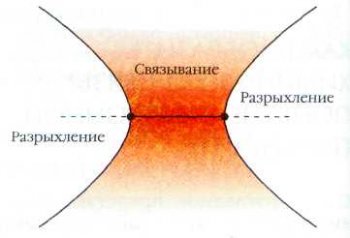
Электроны, проводящие большую часть времени между ядрами, связывают их друг с другом. Электроны, находящиеся за ядрами, стремятся их раздвинуть (этот эффект называют разрыхлением).
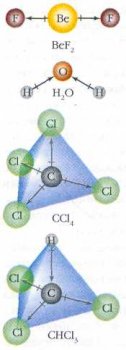
В изображённых молекулах каждая связь полярна. Стрелками отмечено направление смешения электронной плотности, а штрихами на связях — точки, в которых заряд равен нулю. Молекулы BeF2 и CCl4 неполярны — в них связи (стрелки) взаимно компенсируются. В полярных молекулах Н2O и CHCl3 такой компенсации нет.
Похожие статьи