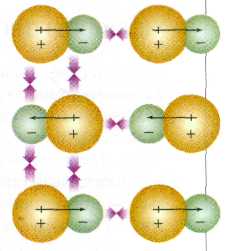
Дипольные взаимодействия в молекулярном кристалле.
Длина связи — это равновесное расстояние между ядрами атомов, соединённых связью. Её можно измерить экспериментально. Обычно длина ковалентной связи составляет 0,1—0,2 нм. Самая короткая связь — 0,074136 нм — в молекуле дейтероводорода HD.
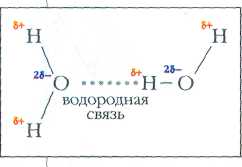
Образование водородной связи между молекулами воды.
Прочность химической связи определяется энергией связи, т. е. энергией, которая необходима для того, чтобы разорвать связь и развести атомы на бесконечное расстояние. Энергия связи изменяется в очень широких пределах. Наиболее прочная связь — в молекулах N2 (945,3 кДж/моль) и СО (1070,3 кДж/моль). Самая сливая ковалентная химическая связь также образуется между атомами азота — в оксиде N2O3 (40,6 кДж/моль), а самая слабая вандерваальсова связь — между атомами гелия (8•10-6 кДж/моль). Наиболее прочными связями являются ковалентные и ионные (энергия связи порядка сотен килоджоулей на моль), затем идут водородные (десятки килоджоулей на моль), самые же слабые — вандерваальсовы.
Полярность связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атома смещать к себе электронную плотность химической связи называют электроотрицателъностью. Самые электроотрицательные элементы — активные неметаллы: F, О, N, Cl; самые электроположительные — щелочные металлы. Чем больше разность электроотрицательностей атомов, участвующих в химической связи, тем более полярна эта связь. Предельный случай полярной связи — ионная связь.
Порядок (или, иначе, кратность) связи в различных теориях химической связи определяют по-разному. В теории электронных пар Льюиса порядок связи — это число электронных пар, осуществляющих химическую связь. Порядок может быть целым или дробным. В теории МО порядок связи для двухатомных молекул определяют как половину разности между числом электронов на связывающих и на разрыхляющих орбиталях. Так, порядок связи в молекуле О2 равен (6-2)/2 = 2, в молекулярном ионе O-2 порядок равен 2,5, а в ионе О+2 — 1,5. Дробный порядок характерен также для многоцентровых связей.
Чем выше порядок, тем большее число электронов обеспечивает связь, и тем труднее её разорвать. Так, энергия тройной связи НСºСН (962 кДж/моль) намного больше энергии двойной связи Н2С=СН2 (712 кДж/моль) и значительно превышает энергию одинарной связи Н3С-СН3 (369 кДж/моль).
Химическими связями обусловлены строение, реакционная способность и химические свойства всех веществ. В самом деле, любая химическая реакция сводится к разрыву старых и образованию новых химических связей. Склонность к разрыву зависит от энергии связи, реакционная способность молекулы — от распределения положительных и отрицательных зарядов в ней, которое определяется полярностью связей. Длины связей задают геометрическую форму молекул и формируют пространственные эффекты в некоторых химических реакциях. Таким образом, точное описание свойств химических связей является важнейшей задачей химии.
Все современные теории химической связи базируются на квантовой теории, основы которой были заложены ещё в 20-х гг. XX в. Уже тогда появились уравнения, описывающие движение ядер и электронов в молекуле. Главную проблему теперь составляют сами вычисления, поскольку квантово-химические уравнения очень сложны. Даже для простейшей молекулы волновая функция зависит от девяти пространственных переменных.
Тем не менее современные методы квантовой химии достигли высокого уровня развития и позволяют описывать строение и свойства весьма сложных молекул. Прогресс в области компьютерных технологий и создания вычислительных алгоритмов, а также большие успехи в разработке приближённых методов решения квантово-химических уравнений позволяют надеяться на теоретическое предсказание и открытие новых интересных молекул с необычными химическими связями.
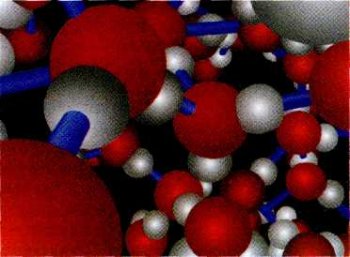
Сеть водородных связей в воле. Красные кружки — атомы кислорода, белые — атомы водорода, синие линии обозначают водородные связи.

Похожие статьи