Понятие валентности в химии долго считалось одним из основных. «Валентность — фундаментальное свойство атома, — писал более века назад знаменитый немецкий учёный, один из создателей теории химического строения Фридрих Кекуле, — свойство такое же постоянное и неизменяемое, как и самый атомный вес». Однако в современной научной литературе этот термин употребляется не очень широко. Более того, даже в учебниках он трактуется по-разному.
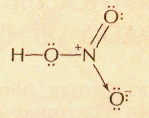
Так, если валентность определять общим числом электронов, участвующих в образовании химических связей с другими атомами, то азот в HNO3 следует считать пятивалентным, поскольку его атом использовал все свои пять внешних электронов — два s-электрона (спаренные) и три р-электрона (неспаренные):
Если же валентность определять числом электронных пар, которыми данный атом связан с другими, то максимальная валентность азота будет равна четырём.
При этом три р-электрона образуют с электронами других атомов три ковалентные связи, а ещё одна образуется за счёт двух s-электронов. Пример — реакция аммиака с кислотами.
Наконец, если определять валентность только числом неспаренных электронов в атоме, то валентность азота не может превышать трёх, поскольку распаривание s-электронов невозможно — для этого у атома азота нет подходящих орбиталей. Например, в галогенидах азот образует только три ковалентные связи, и не существует таких соединений, как NCl5, или NBr5 (в отличие от вполне стабильных РСl5 и РВr5).
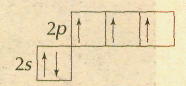
Если же атом азота отдаст один из своих s-электронов, то в образовавшемся катионе N+ останется четыре неспаренных электрона и его валентность будет равна четырём. Так происходит в молекуле HNO3, где один электрон переходит от атома азота к атому кислорода.
Как видим, разные определения валентности приводят к разным результатам даже в случае простых молекул.
Почему так происходит? Можно ли однозначно определить валентность? Чтобы найти ответы на эти вопросы, рассмотрим, как с развитием химии изменялось само это понятие.
Впервые идею об определённой «ёмкости насыщения» атомов металлов и кислорода высказал в 1853 г. английский химик Эдуард Франкленд (1825— 1899). К концу 50-х гг. XIX в. большинство химиков признавали, что валентность (тогда говорили «атомность») углерода равна четырём, кислорода и серы — двум, галогенов — единице. Сам термин «валентность», предложенный в 1868 г. берлинским профессором Карлом Вихельхаусом (1842—1927), был взят из латыни (от лат. valentia — «сила»), однако длительное время почти не употреблялся. В классическом труде «Основы химии» Д. И. Менделеев лишь несколько раз использует как синоним валентности понятие «атомность», не останавливаясь на нём детально и не давая однозначного определения.
И это не случайно. «Ни одно понятие в химии не получало такого количества неясных и неточных определений, как понятие валентности», — писал в 1917 г. американский педагог Александр Смит. Вначале химики ошибочно полагали, что каждый элемент имеет одну валентность. Это неминуемо приво дило к искажению химических формул, которые просто «подгоняли» к такому допущению. В частности, формулы двух известных хлоридов меди записывали так: Cl—Cu—Cu—Cl и Cl—Cu—Cl. По этому поводу Смит делает важный и актуальный во все времена вывод: «Вполне противно научному методу — изобретать или искажать факты в целях поддержки представления, которое, не будучи основано на опыте, является результатом простого предположения. Однако история науки показывает, что подобные ошибки наблюдаются часто». Обзор представлений начала XX в. о валентности дал в 1912 г. известный русский химик Лев Александрович Чугаев (1873—1922). Он отметил, что термин потерял однозначность и первоначальную простоту определения и фактически, по мере развития химии, разделился на несколько понятий — парциальную валентность, главную и побочную и т. д. Первые осложнения начались с признания, что валентность — величина переменная. Теорию немецкого химика Фридриха Карла Иоганнеса Тиле (1865—1918) о парциальных, или частичных, валентностях (см. статью «Ароматический — не значит ароматный») Чугаев считает одной из первых попы- ток расширить классическое понятие валентности. Швейцарский химик Альфред Вернер предположил, что наряду с главными, или основными, единицами валентности существуют другие, побочные. Например, в соединении СоСl3•6NH3 атом кобальта связан одновременно с девятью атомами хлора и азота! Чугаев коснулся также теории немецкого химика Рихарда Абегга (1869— 1910) об электровалентности, которая может быть положительной (в высших кислородных соединениях) или отрицательной (в соединениях с водородом). Валентность при этом определяется числом отдаваемых или принимаемых в реакции электронов. Обзор Чугаева заканчивается упоминанием химических соединений, к которым понятие валентности вообще неприменимо. К ним относятся, например, интерметаллические соединения: NaCd5, NaZn12, FeZn7 и др. Можно привести и другие факты, которые стали известны значительно позже. Так, в озоне пара электронов удерживает не два, а три атома кислорода; в других же молекулах химическая связь может осуществляться вообще единственным электроном. Описать подобные связи без привлечения аппарата квантовой химии невозможно. И эти «неклассические» случаи вовсе не исключение. Как, например, определить валентность атомов водорода и бора в пентаборане В5Н9, в котором некоторые атомы водорода связаны сразу с двумя атомами бора? Какова валентность железа в пентакарбониле Fe(CO)5 (атом железа связан с пятью атомами углерода) или хрома — в пентакарбонилхромате натрия Na2Cr(CO)5? Подобных «нарушителей валентности» становилось всё больше. Возникшие трудности привели к тому, что химики вместо понятия валентности всё шире стали использовать чисто формальное понятие степени окисления. Какие же напрашиваются выводы? По-видимому, традиционное понятие валентности имеет чёткий и однозначный смысл только для соединений, в которых все химические связи являются двухцентровыми (т. е. соединяют только два атома) и каждая связь осуществляется парой электронов, расположенной между двумя соседними атомами, проще говоря — для ковалентных соединений типа HCl, СО2, С5Н12 и т. п. Попытки же дать определение валентности «на все случаи жизни» малопродуктивны и вряд ли нужны. Фактически этот термин стал абстракцией. Недаром авторы многих современных учебников обходятся без него.
Похожие статьи