Очень наглядное представление о химической связи даёт квантовая механика. Эта наука позволяет с высокой точностью рассчитать распределение электронов в молекуле. Функцию, которая описывает вероятность нахождения электронов в любой точке молекулы, называют электронной плотностью. Её измеряют в долях единицы, а для её изображения обычно используют поверхности равной плотности, т. е. выбирают какое-либо значение, например 0,002 или 0,08, и показывают все точки в пространстве, в которых электронная плотность принимает это значение (трёхмерное изображение). Есть и другой способ — выбрать какую-либо плоскость (сечение) и рассматривать значения электронной плотности только в этой плоскости (контурная карта).
Чем же хороша электронная плотность? Во-первых, она позволяет изобразить так называемое электронное облако молекулы. Поверхность с электронной плотностью 0,002 обычно сосредотачивает в себе больше 98% всей электронной плотности, поэтому она отражает размеры и форму электронного облака.
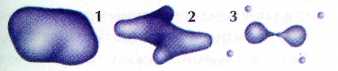
Поверхности равной электронной плотности молекулы этилена С2Н4: 1 — 0,002; 2 — 0,2; 3 — 0,36.
Во-вторых, карты электронной плотности отражают изменение распределения электронов при образовании химической связи из атомов. Чтобы составить такую карту, находят разность электронных плотностей молекулы и свободных атомов. В тех местах, где разность положительна, и концентрируется химическая связь.
В-третьих, распределение электронной плотности показывает, к какому из атомов смещены электроны химической связи. Рассмотрим поверхности равной плотности в трёх молекулах, содержащих атомы водорода: LiH, Н2, HF. Поверхности с уровнем 0,002 свидетельствуют о том, что в молекуле LiH электроны смещены к атому водорода, в молекуле Н2 электронная плотность поделена между атомами поровну, а в молекуле HF она смещена к фтору. Если взять больший уровень плотности, например 0,08, то можно видеть, что в молекуле LiH между атомами электронной плотности почти нет, она полностью смещена к атому водорода. Такую связь называют ионной. В молекулах Н2 и HF электронная плотность в основном находится между атомами, что соответствует ковалентной связи, причём в Н2 эта связь симметричная (неполярная), а в HF — несимметричная (полярная).
Наконец, форма уровней электронной плотности даёт представление о геометрии молекул, которое дополняет информацию, полученную из структурных формул.
Похожие статьи