В сентябре 1886 г. в Берлине проходил съезд естествоиспытателей, к которому приурочили издание журнала, пародирующего самый известный химический журнал того времени — «Berichte der Deutschen Chemischen Gesellschaft» («Доклады Немецкого химического общества»). На обложке вместо слова «Deutschen» было напечатано «Durstigen», что превращало название в «Доклады жаждущего химического общества», иначе говоря, «общества химиков — любителей выпить».
Шутки шутками, но в журнале была опубликована статья «находчивого» господина Финдига «К вопросу о строении бензола», которая фактически предвосхитила теорию Тиле — принцип «остаточных» валентностей у атомов углерода, соединённых двойными связями. «Различные научные дисциплины, — писал автор, — должны помогать друг другу.
Сам Кекуле уверял, что структура бензольного кольца приснилась ему, когда он отдыхал в кресле перед камином. Ровно через 25 лет после этого открытия, когда немецкие химики отмечали «Праздник бензола», учёный так описывал рождение знаменитой формулы:
«...Моя лаборатория находилась в переулочке и даже днём в ней царил полумрак. Для химика, который проводит целые дни в лаборатории, это не было помехой. Я занимался работой над своим „Учебником", но что-то мне мешало, и мои мысли где-то витали. Я повернул кресло к камину и задремал. Атомы принялись танцевать перед моими глазами. На этот раз маленькие группы держались скромно на втором плане. Мой взор, обострённый от повторения одних и тех же образов, обратился скоро к более крупным фигурам различной формы. Длинные нити очень часто сближались и свёртывались в трубку, напоминая двух змей. Но что это? Одна из них вцепилась в собственный хвост, продолжая насмешливо кружиться перед моими глазами. Я внезапно пробудился и на этот раз провёл остаток ночи, чтобы изучить следствия из моей гипотезы».
Вроде бы всё просто. Однако это лишь кажущаяся простота. Кому ещё могут присниться атомы, кружащиеся в танце, как не человеку, длительное время упорно и мучительно размышляющему над связанной с ними проблемой. Открытию Кекуле предшествовала изнурительная научная работа; многие годы он спал по три-четыре часа в сутки. (Он вспоминал: «Одна ночь, проведённая без сна, была не в счёт. Только две или три ночи подряд без сна я считал своей заслугой».) Неудивительно, что именно во время краткого отдыха и произошло важное открытие.
Судя по формуле, бензол — сильно ненасыщенное соединение: по сравнению с насыщенным углеводородом гексаном СбН14, ему «не хватает» восьми атомов водорода! Однако, несмотря на это, для бензола и родственных ему ароматических соединений реакции присоединения («насыщения» атомов углерода) нехарактерны. Так, он не обесцвечивает бромную воду, тогда как соединения С6Н6 со структурой СН2=СН—CºС—СН=СН2 и подобные им реагируют с ней мгновенно. «Насытить» молекулу бензола атомами водорода или галогена удаётся с большим трудом. Например, реакция с хлором СбН6+3Сl2 ®СбНбСl6 идёт только при интенсивном ультрафиолетовом облучении смеси, а водород присоединяется под давлением и при нагревании в присутствии катализаторов, образуя циклогексан С6Н12.
В названиях «бензол», «бензойная кислота», «бензальдегид» один и тот же корень «бенз». История его происхождения очень интересна. В Юго-Восточной Азии, на островах Ява и Суматра растёт дерево, которое выделяет красно-коричневую смолу. Её горение сопровождается приятным запахом. В Средние века арабские торговцы стали вывозить эту смолу для продажи в Европу. Сами купцы называли её яванским ладаном; по-арабски это звучало как «лубан джави» — ладан из Явы.
Европейцам первый слог «лу» напоминал артикли «la» и «le» в итальянском и французском языках. Поэтому они стали называть это вещество «лу банджави», а потом, отбросив мнимый «артикль», — «банджави». Позднее слово произносили и как «бенджами», и как «бенджоин», а примерно с середины XVII в. — как «бензоин».
В 1832 г. Юстус Либих заинтересовался химическими свойствами «горькоминдального масла» (бензальдегида, С6Н5СНО). Это было сравнительно доступное органическое вещество, а в то время химики изучали только такие соединения, которые легко можно выделить из природных источников. При действии галогенов на миндальное масло Либих получил бензоилхлорид С6Н5СОСl и бензоилбромид С6Н5СОВr. Реакция любого из этих соединений с водой давала хорошо известную бензойную кислоту С6Н5СО—ОН: С6Н5СОВr+Н2О®C6H5OOH+НВr.
Либих выделил и другие производные бензальдегида. И во всех превращениях сохранялась неизменной группировка атомов состава С7Н5О. Эту группировку — радикал бензойной кислоты Либих назвал бензоилом.
Открыть бензол, как это нередко бывает, помог случай. Начиная с 10-х гг. XIX в. в Лондоне для освещения улиц в фонарях стали использовать светильный газ. Его получали сухой перегонкой каменного угля и хранили под давлением в герметических ёмкостях. При этом в сосудах накапливалась неизвестная жидкость, особенно обильно — в холодную погоду. Фарадей начал изучать её и 18 мая 1825 г. выделил соединение, которое кипело при 80 °С. Учёный очистил его вымораживанием: при температуре 7 °С вещество превращалось в белую кристаллическую массу, тогда как все примеси оставались жидкими. К началу июня Фарадей провёл элементный анализ нового соединения и определил, что оно содержит углерод и водород в соотношении 11,4:1. Полученные Фарадеем данные практически соответствуют установленным современными учёными характеристикам бензола: он кипит при 80,1 °С, затвердевает при 5,53 °С и имеет соотношение С:Н=11,9:1.
Пользуясь относительными атомными массами Дальтона (Н=1, С=6), Фарадей приписал полученному им соединению неверную формулу С2Н, назвав его «bicarburet of hydrogen», т. е. «двууглеродистым водородом». Однако вскоре шведский химик Якоб Берцелиус опубликовал уточнённую таблицу атомных масс элементов (Н=1, С=12,26), в соответствии с которой открытый Фарадеем углеводород должен был иметь простейшую формулу СН. Истинную формулу этого соединения С6Н6 установили уже после того, как удалось определить его молекулярную массу.
Майкл Фарадей.
Среди 18 миллионов известных на сегодняшний день органических соединений немного найдётся таких, которые повлияли бы на развитие органической химии сильнее, чем бензол. Полученный впервые в 1825 г., он более века был постоянной головной болью химиков. Сначала не могли понять, как выглядит молекула бензола. Потом десятилетиями пытались объяснить его уникальные свойства.
Первооткрыватели циклоалканов сразу отметили разницу в химическом поведении малых и средних углеродных циклов. Отталкиваясь от этих различий в свойствах и пытаясь их обосновать теоретически, А. Байер создал учение о внутренних напряжениях в циклических молекулах.
При обычных условиях (t=20 °С, р=1 атм) малые циклоалканы существуют в виде газов, средние — легколетучих жидкостей, а большие — как вязкие нелетучие масла. Будучи веществами с практически неполярными молекулами, все они не растворимы в воде.
Наиболее напряжённый из циклоалканов — циклопропан: из-за отталкивания электронных облаков его буквально распирает изнутри. Он раскрывается с разрывом углерод-углеродных связей в цикле при любом химическом воздействии. Вещества, которые реагируют с циклопропаном, вступают с ним в реакции присоединения, сопровождающиеся раскрытием его углеродного цикла. Водород гидрирует самый младший алицикл уже при температуре 80 °С, превращая его в линейный пропан:
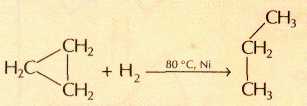
Вторая половина XIX столетия для молодой органической химии оказалась периодом, с одной стороны, становления её теоретических основ, а с другой — совершенствования экспериментального мастерства исследователей. Именно тогда родилось новое направление в этой области химического знания — органический синтез, основной задачей которого стало изучение синтетических методов получения различных органических веществ. Именно благодаря усилиям химиков-синтетиков конца XIX — первой половины XX столетия были созданы классические общие методы синтеза простых алициклов и их различных производных.
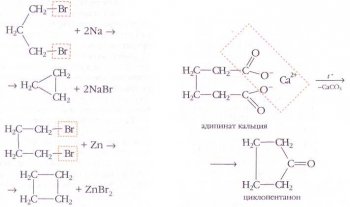
Одним из универсальных лабораторных способов получения циклоалканов и их гомологов является действие металлического натрия или цинковой пыли в неполярном растворителе на дибромалканы, не содержащие атомы галогена у соседних атомов углерода:
К простейшим терпенам циклического строения относится лимонен С10Н16 — он входит в состав лимонного и мятного масел. Однако главной составной частью мятного масла является спирт ментол С10Н19ОН — производное углеводорода ментана (1-метил-4-изопропилциклогексана С10Н20). Ментол — кристаллическое вещество с запахом мяты и приятным холодящим вкусом. В качестве ароматизатора его добавляют в зубные пасты, жевательные резинки. Кроме того, это действующее начало некоторых лекарственных препаратов, например валидола — раствора ментола в ментиловом эфире изовалериановой кислоты. Это лекарство снимает приступы стенокардии, расширяя кровеносные сосуды.
Как известно, углерод — основной элемент любого органического вещества. В отличие от подавляющего большинства элементов периодической системы, он обладает замечательной особенностью — способностью образовывать устойчивые циклические молекулы.
Среди соединений из двух элементов — углерода и водорода (углеводородов) — есть обширный класс веществ, циклические молекулы которых содержат только одинарные углерод-углеродные связи или одиночные кратные связи. Такие углеводороды и их многочисленные производные называются алициклическими (от греч. «алифатос» — «жир» и «циклос» — «круг»).
Сбор терпентина (скипидара).
Миниатюра из рукописи «Книги о простейших лечебных средствах»
Платтеария Маттеуса. Середина XV в. Франция.
С незапамятных времён человек пользуется дарами природы — разнообразными полезными веществами. Ценнейшие амбра и мускус, лимонное и мятное масло издавна входили в состав восточных благовоний. Лекарствами служили камфора, получаемая из листьев камфорного лавра, а также терпентиновое масло — из смолы хвойных деревьев...
Несмотря на известные до тонкостей способы выделения и применения подобных подарков природы, их состав и строение долго оставались неизвестными — ведь химии до становления как науки пришлось проделать долгий путь.
Состав и строение давно известных природных веществ были определены лишь в XIX в. И оказалось, что многие душистые вещества растительного и животного происхождения, лекарственные средства имеют в своём составе углеродные циклы.