Ртуть была известна людям уже во II тысячелетии до н. э. Алхимики считали её женским началом веществ, матерью металлов, основой философского камня. Они называли её argentum vivum («живое серебро»), hydrargirum («жидкое серебро») или Mercurius, подчёркивая тем самым её близость к царю металлов — золоту (планета Меркурий расположена ближе всех к Солнцу, символом которого является золото).
Алхимический символ ртути совпадает с обозначением планеты
Меркурий у астрономов:

Кадмий практически не образует собственных минералов и встречается только в виде примесей к цинксодержащим рудам.
В 1817 г. окружной врач Магдебурга Иоганн Ролов заподозрил, что в оксиде цинка, который производили на шёнебекской фабрике Германа, содержится ядовитая примесь — мышьяк.
Соединения кадмия.
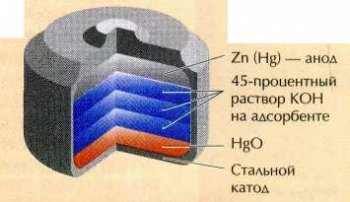
На способности цинка вытеснять ртуть из её соединений основано действие ртутно-цинкового гальванического элемента. В нём протекает следующий процесс: Zn+HgO=Hg+ZnO.
Ртутно-цинковые элементы не имеют равных по надёжности, стабильности напряжения и количеству «запасённого» электричества в единице массы. Они идеальны для использования в полевых условиях.
Однако ртуть составляет больше половины их массы. После того как батарейки выработают свой ресурс, возникает проблема их утилизации. Если просто выбрасывать такие элементы на свалку, воздух в её окрестностях будет отравлен. Поэтому в мире ширится кампания против использования ртутно-цинковых элементов. В частности, в открытую продажу они уже давно не поступают. А на батарейках, которые продаются в магазинах, можно прочесть: «Mercury 0%» или «Mercury free», что означает «ртути нет».
Схема ртутно-цинкового элемента.
Древние металлурги знали, что если минерал галмей (смитсонит ZnCO3) нагреть с углём в присутствии меди, то образуется слиток, по цвету напоминающий золото (впоследствии этот медно-цинковый сплав стали называть латунью). Однако в семёрку известных с древности металлов (железо, медь, золото, серебро, олово, ртуть, свинец), цинк не вошёл, так как его не удавалось выделить в чистом виде. При прокаливании галмея с углём без меди получался странный белый порошок — оксид ZnO, образующийся при взаимодействии паров цинка с кислородом воздуха. Металлический цинк люди научились выплавлять только к началу новой эры. Для этого галмей нагревали с углём в закрытых сосудах, а выделяющиеся пары конденсировали в охлаждаемых глиняных ретортах. Технология по тем временам была достаточно сложной, а химической сути процесса тогда не понимали, поэтому к X в. секрет изготовления цинка оказался утрачен. Вновь о цинке вспомнили спустя несколько столетий. Алхимик Андреас Либавий назвал его восьмым металлом, присоединив к семи металлам древности. А название «цинк» впервые встречается у Парацельса. Выплавку цинка описал Георг Агрикола в своём труде «О горном деле и металлургии». Однако промышленное производство этого металла наладили только в 1743 г. в Бристоле (Англия).
Иногда серебряные предметы не чернеют, а зеленеют. Это верный признак того, что в сплаве кроме серебра содержится изрядное количество меди — его часто называют «низкопробным серебром». Зелёный налёт включает основной карбонат меди (CuОН)2СО3 и образуется под действием углекислого газа, паров воды и кислорода.
Некоторые сплавы, внешне очень похожие на серебро, могут вовсе не содержать драгоценного металла. Наиболее известные из них — нейзильбер (нем. Neusilber — «новое серебро») и мельхиор {нем. Melchior, искажение французского слова maillechort, образованного по именам изобретателей сплава Майо — Maillot и Шорье — Chorier). В нейзильбер входит кроме меди от 15 до 35% никеля и от 12 до 46 % цинка, а в мельхиор — от 20 до 30 % никеля, 0,8 % железа и 1 % марганца.
Герой известного романа А. Н. Толстого «Гиперболоид инженера Гарина» надеялся разбогатеть, найдя в глубинах Земли «золотой слой». Кульминационный момент описан весьма подробно, но... Давайте вчитаемся.
«Гарин, Чермак и инженер Шефер опускались в лифте в глубину главной шахты...
...Стоя внутри кротовой системы на кольцевой площадке, Гарин наблюдал необычайное явление. Сверху, с воронки, собирающей газы, пошёл ртутный дождь. Пришлось прекратить действие гиперболоидов. Ослабили замораживание на дне шахты. Черпаки прошли оливин и брали теперь чистую ртуть. Следующим номером, восемьдесят первым, по таблице Менделеева за ртутью следовал металл таллий. Золото (по атомному весу — 197,2 и номеру — 79) лежало выше ртути по таблице.
То, что произошла катастрофа и золота не оказалось при прохождении сквозь слои металлов, расположенных по удельному весу, понимали только Гарин и инженер Шефер. Это была катастрофа!..
Испокон веков мерцающий блеск золота возбуждал людскую алчность, манил вдаль бесчисленных искателей приключений, становился причиной кровавых войн. «О, если бы оно могло быть совсем изгнано из жизни!» — восклицал Плиний Старший. Ещё в глубокой древности золотистый цвет металла ассоциировался в сознании людей с цветом солнца. Так, по одной из версий, русское название металла происходит от слова «солнце». Латинское название элемента (Aurum) в переводе означает «жёлтый».
При длительном хранении на воздухе серебряные изделия (ложки, кресты, украшения) тускнеют — покрываются тончайшим слоем сульфида серебра:
4Ag+2H2S+О2=2Ag2S+2Н2О.
Для того чтобы вернуть изделию прежний блеск, необходимо снять образовавшуюся сульфидную плёнку. Это можно сделать химическим путём. По одному из методов изделие кипятят в содовом растворе в алюминиевой посуде или в любой другой, но с добавлением кусочков алюминия (проволоки, фольги). В щелочной среде, образующейся при гидролизе соды, алюминий восстанавливает серебро до металла:
3Ag2S+2Al+5NaOH+3H2O=6Ag¯+2Na[Al(OH)4]+3NaHS.
В старину потускневшие серебряные предметы опускали на несколько минут в раствор цианистого калия
KCN. В настоящее время использования ядовитого цианида реставраторы стараются избегать: его заменяют роданидом калия KSCN или аммония NH4SCN. Оба эти вещества связывают ионы Ag+ в прочные комплексные соединения, например K[Ag(SCN)2].
Серебро с давних времён используют для лечения различных болезней. В наши дни в медицинской практике применяют нитрат серебра и коллоидные препараты серебра — колларгол и протаргол, в которых этот металл находится в растворе в виде мельчайших твёрдых частиц. Чтобы они не выпадали в осадок, в препараты вводят специальные стабилизирующие добавки. В колларголе это яичный белок — альбумин. Сухой колларгол — синий порошок, содержащий около 75 % серебра. Колларгол и протаргол в виде водных растворов и мазей применяют для смазывания воспалённых слизистых оболочек верхних дыхательных путей, в глазных каплях, для промывания гнойных ран, при рожистых воспалениях и т. д.
Иногда поверхность серебряных изделий покрывают слоем черни — плёнки из сульфида серебра Ag2S. В зависимости от толщины и способа получения цвет черни изменяется от бархатисто-серого до чёрного. Предметами и ювелирными украшениями, выполненными в технике серебряной черни, прославились мастера города Великий Устюг. Аля получения черни мастер готовит особый состав — серную печень, которая представляет собой порошок, состоящий из смеси тиосульфата и полисульфидов калия. Они образуются при сплавлении серы с поташом в массовом соотношении 1:1,5
4К2СО3+14S+О2 = 2K2S5+2K2S2O3+4СО2.
Горы Центральной Европы — Рудные, Гарц, а также горы Богемии, Саксонии с древних времён славились богатством недр. Здесь добывали железо, золото, олово, медь, серу, мышьяк, каменный уголь и многие другие полезные ископаемые. Издавна эти места были знамениты серебряными рудниками. С 1518 по 1907 г. из серебра, месторождения которого располагались близ города Иоахимсталя (ныне Яхимов в Чехии), были отчеканены миллионы монет. Вначале они так и именовались — «иоахим-сталеры». Затем это название в Европе укоротилось за счёт первой части слова до «талера», а в России — за счёт второй — до «ефимки». Талер был в ходу по всей Европе, став самой распространённой большой серебряной монетой, от него произошло и название доллара. Серебряные рудники Германии были тоже очень богаты. Из добывавшегося в них металла делали огромные вазы и столовые сервизы на сотни персон, на каждый из которых расходовали тонны серебра! Легенда приписывает открытие одного из месторождений германскому императору Оттону I (912—973) и его егерю. Вот как она выглядит в изложении М. В. Ломоносова: «Сей государь, будучи в Гарцских горах, забавлялся немалое время охотою и некогда послал своего охотника, называемого Раммелем, в тамошний лес для ловли диких зверей, за которыми он, гнавшись до горы, где ныне рудники учреждены в великом множестве, не мог за дичью ради трудности на коне следовать, для того, привязав его к дереву, за зверьми пеш помчался. А когда к коню назад возвратился, то увидел, что он, господина своего с нетерпением ожидая, землю копытами разрыл и из ней выбил некоторые тяжёлые и светлые камни. Сии камни взяв, Раммель привёз и показал самому императору, который, через пробование удостоверившись, что они металл в себе содержат, велел учредить заводы на том месте. Оная гора и поныне именем помянутого егеря Раммельсберг называется».
Хотя серебро с кислородом непосредственно не реагирует, оно может растворять в себе немало этого газа. Растворимость кислорода в твёрдом серебре максимальна при температуре 450 °С, когда 1 объём металла способен поглотить 5 объёмов кислорода. Значительно больше кислорода (до 20 объёмов на 1 объём серебра) растворяется в жидком металле.
Этот процесс сопровождается красивым (и опасным) явлением, которое известно с древних времён, — разбрызгиванием серебра. Происходит оно вот почему. Когда жидкое серебро затвердевает (при температуре 962 °С), сначала, как правило, застывает верхний слой металла. На поверхности образуется корка, под которой ещё находится жидкое серебро. Если расплавленный металл поглотил много кислорода, то затвердевание сопровождается обильным высвобождением газа. Под давлением выделяющегося кислорода корка разрывается, и происходит взрывное разбрызгивание металла, словно серебро плюётся.