Древние металлурги знали, что если минерал галмей (смитсонит ZnCO3) нагреть с углём в присутствии меди, то образуется слиток, по цвету напоминающий золото (впоследствии этот медно-цинковый сплав стали называть латунью). Однако в семёрку известных с древности металлов (железо, медь, золото, серебро, олово, ртуть, свинец), цинк не вошёл, так как его не удавалось выделить в чистом виде. При прокаливании галмея с углём без меди получался странный белый порошок — оксид ZnO, образующийся при взаимодействии паров цинка с кислородом воздуха. Металлический цинк люди научились выплавлять только к началу новой эры. Для этого галмей нагревали с углём в закрытых сосудах, а выделяющиеся пары конденсировали в охлаждаемых глиняных ретортах. Технология по тем временам была достаточно сложной, а химической сути процесса тогда не понимали, поэтому к X
С тех пор принципиальных изменений способ выделения цинка не претерпел: цинксодержащую руду (например, цинковую обманку ZnS) обжигают, образовавшийся оксид нагревают с углём в замкнутых печах, и пары цинка конденсируют: 2ZnS+3О2®900 °C2ZnO+2SO2 ZnO +С®1100 °CZn+CO. В наше время Zn получают также электролизом раствора сульфата цинка, образующегося при обработке цинковой руды серной кислотой. Цинк — активный металл, он вытесняет водород из растворов кислот, а также менее активные металлы из растворов их солей: Zn+CuSO4=Cu+ZnSO4. Оксид ZnO и гидроксид Zn(OH)2 — вещества амфотерные. Они реагируют как с кислотами: Zn(OH)2+2НСl=ZnCl2+2H2O,
По объёму производства цинк находится на четвёртом месте среди металлов, уступая только железу, алюминию и меди.
Основная масса цинка идёт на покрытие железа для защиты его от коррозии. Из оцинкованного железа изготовляют кровельные листы, водосточные трубы, вёдра и многие другие изделия.

Цинк — серебристо-белый металл (tпл=420 °С, tкип=906 °С), хрупкий при комнатной температуре. При хранении на воздухе он приобретает лёгкий голубоватый оттенок, покрываясь тонкой плёнкой оксида ZnO или основного карбоната 2ZnCO3•Zn(OH)2, предохраняющей его от дальнейшего окисления.
Цинком покрывают кровельное железо. Обратите внимание на проржавевшую решётку, которая не была оцинкована. Даже если цинковое покрытие будет повреждено, железо всё равно не начнёт ржаветь до тех пор, пока не прокорродирует весь цинк.
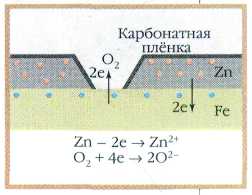
Цинк активнее железа, поэтому при контакте отдаёт ему некоторое количество электронов, и поверхность железа заряжается отрицательно. Электроны, которые переходят на кислород с поверхности железа, первоначально принадлежали цинку. Так цинк, разрушаясь сам, защищает железо.
Часы из латуни. Конец XVII — начало XVIII в.
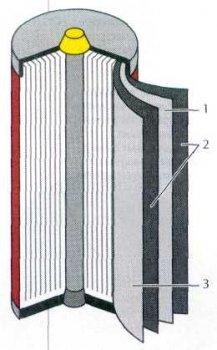
Устройство никель-кадмиевого аккумулятора. Электроды представляют собой стальные сетки, в которые впрессован губчатый кадмий (анод) или гидроксид никеля NiO(OH) (катод). Пространство между электродами заполнено влажной щёлочью КОН.
1 — стальная сетка с губчатым кадмием;
2 — желеобразный состав, содержащий влажную щёлочь;
3 — стальная сетка с NiO(OH).
Латуни — медно-цинковые сплавы (содержат от 4 до 50% Zn)
Сплавы на основе цинка обладают хорошими литейными качествами. Из них, например, легко отлить гайку с уже готовой резьбой. (Для стали такая возможность пока остаётся несбыточной мечтой.) Поэтому такие сплавы активно используют для отливки изделий с очень тонким рельефом поверхности, например типографских шрифтов.
Оксид цинка ZnO (tпл=1975 °С) используется как наполнитель для придания прозрачной пластмассе белого цвета, а в смеси с олифой — в качестве белой краски (цинковые белила). Белый порошок сульфида цинка ZnS, в котором часть атомов Zn замещена на Cd, a S на Se, под действием потока электронов излучает видимый свет — тонкий слой этого вещества наносят на экраны телевизоров, рентгеновские трубки.
В организме взрослого человека содержится около 2,3 г цинка, который входит в состав более 40 ферментов, регулирующих углеводный и энергетический обмен в клетках.


Похожие статьи