Сейчас трудно представить нашу жизнь без электричества. Однако ещё не так давно к фонарям на улицах тянулись не провода или электрические кабели, а трубы с газом. Газовое освещение появилось в начале XIX в. Светильный газ получали перегонкой каменного угля или древесины без доступа воздуха, и подобное производство являлось мощной отраслью промышленности.
Вообще-то сам по себе горящий газ даёт мало света. Резко увеличить освещённость горелки можно, поместив в пламя подходящее вещество, которое, разогреваясь, начинает само светиться. Вначале таким усилителем, «рабочим телом» служила платиновая проволока, но подобные горелки были очень дороги.
Настоящую революцию в осветительном деле совершил австрийский химик Карл Ауэр (1858—1929). Кстати, основные его исследования посвящены изучению редкоземельных элементов. Работая в лаборатории немецкого химика Роберта Бунзена, Ауэр заметил: если тугоплавкие оксиды редкоземельных элементов нагреть в пламени горелки, они начинают ярко светиться. Учёный начал интенсивно работать над усовершенствованием газовой горелки.
В старых учебниках по химии можно найти любопытное упоминание о церии — металле, который обладает удивительным свойством: если проволоку из него поскрести ножом, то образующиеся при этом мельчайшие пылинки самовоспламеняются на воздухе (такое свойство металла называется пирофорностью — от греч. «пир» — «огонь» и «форос» — «несущий»). Если же внести в пламя саму цериевую проволоку, она вспыхивает ослепительным огнём, превосходя по яркости горящий магний.
Необычное свойство церия использовал австрийский химик Карл Ауэр фон Вельсбах, разработав состав для «кремнёвых» зажигалок. В его основе — сплав церия с другими редкоземельными металлами (мишметалл — от нем. mischen— «смешивать»), образующийся при восстановлении смеси их оксидов кальцием. Небольшой кусочек подобного вещества при ударе (или энергичном трении о стальное колесико) даёт множество искр, которые легко поджигают фитиль. Для кремней зажигалок оптимален такой состав: Ce — 66%, Fe — 25%, La — 8%, Mg — 0,5%, Cu — 0,5%. Зажигалки позволили сэкономить огромное количество спичек.
Аналогичный сплав на основе церия используется также в трассирующих (светящихся) пулях и снарядах. Специальная насадка из пирофорного сплава надета на снаряд снаружи, а роль колёсика в зажигалке, высекающего искру, здесь играет воздух. При больших скоростях трение насадки о воздух заставляет снаряд искрить, в результате чего ночью легко проследить его путь к цели.
Оксиды некоторых лантанидов используют как катализаторы крекинга нефти (см. статью «Нефть. Метаморфозы»), а также для окраски стёкол: добавка оксида неодима придаёт стеклу фиолетовый оттенок, эрбия — розовый, празеодима — зелёный, церия (IV) — жёлтый. Соединения на основе сульфидов (Ln2S3) и оксисульфидов (Ln2O2S) редкоземельных элементов служат люминофорами в экранах цветных телевизоров и дисплеях компьютеров. В галогенные лампы вводят люминофоры на основе иодидов лантанидов. Они дают люминесцентное свечение разных цветов. Лантан и лантаниды — тугоплавкие металлы серебристо-белого цвета
Наиболее сильно ферромагнитные свойства выражены не у индивидуальных простых веществ, а у сплавов лантанидов с ферромагнитными металлами. При сплавлении металлов иногда образуются химические соединения — интерметаллиды. Примером может служить SmCo5. На основе этого и подобных ему соединений в наше время изготовлены наиболее мощные постоянные магниты: сравнительно небольшой магнит, который умещается на ладони, способен удержать легковой автомобиль вместе с пассажирами!
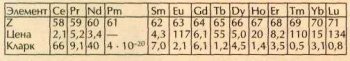
Так как у лантанидов наружные электронные оболочки построены одинаково, их химические свойства весьма сходны. Казалось бы, и встречаться в природе, и цениться они должны тоже одинаково. Однако таблица цен и распространённости лантанидов показывает, что это не так:
Во второй строке таблицы приведён порядковый номер элемента Z, в третьей — округлённая цена в долларах за 1 г металла в слитке чистотой 99,9 % (в ценах 2000 г. компании «Олдрич»). В графе прометия стоит прочерк: у этого элемента нет стабильных изотопов, один из самых долгоживущих — прометий-147 (период полураспада 2,62 года) — получают искусственно и используют в миниатюрных атомных батарейках. В 1998 г. 1 г 147Pm стоил примерно 10 млрд. долларов. Конечно, никто прометий граммами (и даже микрограммами) не покупает: его количество измеряют единицами активности — беккерелями и мегабеккерелями; для 147Pm 1МБк соответствует 3•10-9 г прометия.
Сплавы некоторых редкоземельных элементов с переходными металлами (например, LaNi5) способны поглотить в 1,5 — 2 раза больше водорода, чем его содержится в таком же объёме жидкого водорода. Это объясняется тем, что, попадая в пустоты кристаллической решётки металла, молекулы водорода распадаются на атомы, образующие связи с атомами металлов. А при незначительном нагревании сплав, насыщенный водородом, легко его отдаёт. На основе LaNi5 уже разработаны аккумуляторы водорода, которые могут использоваться при развитии водородной энергетики.
В 1794 г. Юхан Гадолин (1760—1852) (в честь него назван элемент гадолиний) из университета города Або в Финляндии выделил из редкого минерала (теперь он именуется гадолинитом), найденного в местечке Иттербю близ Стокгольма, новую землю, которую назвал иттриевой. В 1803 г. из другого минерала Якоб Берцелиус и Вильгельм Хизингер, а также Мартин Клапрот (независимо от первых двух) получили цериевую землю, названную по имени малой планеты Цереры, открытой незадолго до этого.
Потребовалось ещё несколько десятилетий, чтобы доказать, что эти земли неоднородны, т. е. не являются индивидуальными соединениями. Так, в 1839—1841 гг. шведский химик Карл Густав Мосандер (1797—1858) выделил из цериевой земли две новые — лантановую (от греч. «лантано» — «скрываюсь») и дидимовую (от греч. «дидимаон» — «близнецы»).
Лантаниды относят к редким элементам: их содержание в земной коре не превышает по массе 0,01%. Однако 0,01% — не так уж мало. Например, атомов церия — наиболее распространённого из лантанидов — в природе содержится в пять раз больше, чем атомов свинца, а тулия — самого редкого из членов этого семейства — больше, чем иода. Единственное исключение — прометий, у которого нет стабильных изотопов, и потому он в природе практически не встречается.
В литературе нередко используется также термин редкоземельные элементы. Под ним понимают группу из 17 элементов, включающую трёх представителей побочной подгруппы третьей группы — скандий Sc, иттрий Y, лантан La и 14 лантанидов (общий символ — Ln). Термин этот исторический. Раньше землями называли тугоплавкие оксиды многих элементов (магния, кальция, бария, алюминия и др.). Название «редкие земли» закрепилось первоначально за оксидами иттрия и церия, а затем было распространено и на другие близкие по свойствам элементы.
Один из важнейших минералов лантанидов — монацит (Y, La, Ln)PO4 — содержит сразу все или почти все лантаниды, но в разном соотношении, а также иттрий и лантан. Название минерала происходит от греческого «моназо» — «уединяюсь», «обособляюсь», ведь монацит встречается обычно в виде отдельных зёрен. Из-за присутствия тория, а также следов других радиоактивных элементов монацитовая руда (монацитовый песок) радиоактивна.
Близкие значения ионных радиусов и очень похожие химические свойства делают лантаниды настолько сходными, что долгое время их не удавалось разделить.
При взгляде на таблицу Менделеева невольно возникает вопрос: почему некоторые элементы помещены не в самой таблице, а как бы вынесены за её пределы? Что это — знак особой чести, уважения или, наоборот, свидетельство пренебрежительного отношения к ним: мол, хватит вам одной клетки в самой периодической системе? К тому же и называют их в разных таблицах по-разному: то лантаноидами и актиноидами, то лантанидами и актинидами...
Есть у них ещё одно общее название: и лантаниды, и актиниды — это f-элементы, поскольку в их атомах достраивается внутренняя электронная f-оболочка. Всего на ней может разместиться не более 14 электронов; ровно столько же и наших героев — лантанидов (иначе 4f-элементов) и актинидов (5f-элементов).
Лантаниды расположены в периодической системе после лантана, актиниды — после актиния. Их отсутствие (в явном виде) в III группе таблицы отмечено звёздочками у символов La и Ас.
Окрашенные соли лантанидов.
Ртутное месторождение Монте-Амьята в Италии разрабатывается со времён Древнего Рима. Причина столь ранней известности ртути в том, что добываемая там киноварь (сульфид ртути HgS) легко разлагается при нагревании на воздухе с образованием паров металлической ртути:
В древности обжиг киновари проводили в закрытом глиняном сосуде, на крышке которого конденсировалась ртуть. Сейчас для этих целей используют трубчатые печи.
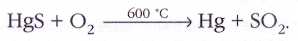
Ртуть (tкип=357 °С) — самая тяжёлая из всех известных жидкостей:
Разбитый градусник — довольно частая ситуация. Ртуть разбегается в виде мельчайших блестящих шариков, забивается в щели и медленно испаряется, отравляя воздух в помещении. Поэтому разлитую ртуть нужно полностью собрать. В крупных городах удалением ртути из помещений занимаются специальные службы. Если же по какой-то причине связаться с ними не удаётся, нужно поступать следующим образом. В первую очередь откройте окно, чтобы комната хорошо проветривалась. Затем соберите видимые глазом капли ртути, пользуясь зачищенной медной проволокой (а лучше медным проводом, сплетённым из множества тонких проводков) или, в крайнем случае, бронзовой монетой. Ртуть легко прилипает к меди и перестаёт растекаться. Все использованные вами предметы вместе с собранной ртутью сложите в баночку и вынесите на улицу.
Далее надо ликвидировать мелкие капли ртути, которые не удалось собрать, и те, что затекли в щели. Самый надёжный способ — засыпать все места, куда могла попасть ртуть, хлоркой, хлорамином или любым дезинфицирующим средством, содержащим хлор. Подойдут даже хлорсодержащие отбеливатели. Рассыпанный порошок следует смочить (именно смочить, а не залить) водой, и оставить на несколько часов. За это время ртуть превратится в хлорид ртути (II) или оксид ртути (II) (в зависимости от того, что вы использовали). Теперь аккуратно соберите кашицу и сложите её в полиэтиленовый пакет. Остатки хлорки уберите влажной тряпкой, положите её в тот же пакет и отнесите на помойку.
Вместо хлорки ртуть можно обработать насыщенным раствором хлорного железа, которое окисляет металл:
2FeCl3+2Hg=2FeCl2+Hg2CI2,
а через сутки собрать раствор сухой тряпкой (разумеется, в резиновых перчатках). Применяют также настойку иода:
Hg+I2+2KI=K2[HgI4]
или раствор марганцовки. К сожалению, ни хлорное железо, ни иодную настойку нельзя использовать на паркетном полу, а иод ещё и на линолеуме. Ртуть можно также засыпать серой, однако реакция Hg+S=HgS протекает лишь на поверхности ртутных шариков. А из глубины ртуть продолжает спокойно испаряться.
Отравления делятся на острые (если в организм сразу попадает большая доза яда) и хронические (когда человек получает яд понемногу, но постоянно).
История знает немало случаев массового отравления ртутью при золочении различных крупных предметов амальгамой золота. Множество рабочих отравились, когда золотили купола Исаакиевского собора в Санкт-Петербурге. Ртуть или её соли часто оказывались «последним средством» в дворцовых интригах. Ими были отравлены Елена Глинская — мать Ивана Грозного и царица Анастасия — его первая жена. Хроническое ртутное отравление — профессиональная болезнь средневековых шляпников, использовавших соединения ртути для выделки фетра. Безумный Шляпник из кэрролловской «Алисы в Стране Чудес» —типичный пример такого больного. Из-за хронического отравления ртутью потеряли работоспособность Исаак Ньютон, Майкл Фарадей и Блез Паскаль.
Если парами ртути заполнить стеклянную трубку и приложить к её концам напряжение, то в ней возникают заряженные частицы: Hg=Hg++e. При этом ионы ртути устремляются к отрицательно заряженному электроду, а электроны — к положительному. При обратном процессе Hg++е-=Hg* образуются возбуждённые атомы, которые теряют энергию, испуская квант света. Большая часть излучения приходится на ультрафиолетовую часть спектра.
Ртутную лампу называют ещё кварцевой, поскольку трубку делают из кварца, прозрачного для ультрафиолета. Такие лампы используют в лабораториях для проведения фотохимических реакций, в банковском деле для распознания подлинности банкнот, а также в аппаратах искусственного загара. Ультрафиолетовые лучи вредны для глаз, так что ртутная лампа не годится для освещения. Однако стекло лампы можно покрыть изнутри люминофором — веществом, которое поглощает ультрафиолет и при этом излучает видимый свет. Получится так называемая люминесцентная лампа, свет от которой по параметрам соответствует дневному (лампа дневного света).