Как это часто бывает, люди начали употреблять ферменты для своих нужд намного раньше, нежели появилось первое туманное представление о том, что же это такое. Конечно, о выделении ферментов тогда не было и речи: чтобы получить алкоголь или поднять тесто, использовали дрожжи, для створаживания молока — кусочки сычуга (отдела желудка травоядных). Иными словами, в дело шли природные хранилища ферментов.
При изготовлении многих привычных нам пищевых продуктов используются ферментативные процессы.
Растительные и животные ткани и живые микроорганизмы применяются и теперь, но в некоторых случаях предпочтительнее потратиться на выделение чистого фермента. Так, замечательные отстирывающие свойства многих современных порошков обусловлены добавками ферментов, расщепляющих жиры, белки и другие молекулы загрязнителей. Ведь не примешаешь же к стиральному порошку мелко порубленную ткань, выделенную из организма.
В XIX в., когда были выделены различные ферментные препараты и описаны удивительные свойства ферментов, учёные не могли не задуматься: а каким же образом работают ферменты? Чему они обязаны своей способностью ускорять реакции и столь поразительной избирательностью?
В 1894 г. немецкий химик Эмиль Герман Фишер начал цикл работ по изучению действия ферментов. В результате он пришёл к выводу, что между ферментом и субстратом (так называют реагирующее вещество) должно существовать соответствие молекулярных конфигураций, подобное сходству конфигураций замка и ключа. Эта яркая и наглядная картинка хорошо объясняет специфичность действия ферментов: в самом деле, к замку подходит только определённый ключ. Что считать «замком», а что «ключом» — неважно. Важно лишь то, что «выемки» и «выступы» в структурах фермента и субстрата подходят друг другу уникальным образом. «Ключ, вставленный в замок», т. е. субстрат, связанный с ферментом, называют промежуточным фермент-субстратным комплексом.
Схема, предложенная Фишером, живёт уже более ста лет и не стареет. Но, к сожалению, она объясняет не всё. Если «ключику» так удобно лежать в «замочной скважине», почему он превращается во что-то другое? Ведь тогда соответствие конфигураций неизбежно нарушается. Чтобы истолковать это, были предложены разные уточнения модели Фишера.
Зажигалка была изобретена Иоганном Вольфгангом Дёберейнером в 1823 году. Он заметил, что водород, направленный на губчатую платину, воспламеняется. Данный опыт тогда не нашёл объяснения, все посчитали его простым фокусом. Но ученый не растерялся, а обнаружил в нём практическую пользу, разработал на основе этого процесса огниво и потом даже получил патент. Огниво оказалось громоздким и дорогостоящим, поскольку в нём использовалась платина. Так что оно не пользовалось популярностью.
С чем связаны замечательные свойства ферментов? Очевидно, причина не в своеволии таинственного духа fermentum. Свойства вещества закономерно вытекают из его строения.
Ещё в XVIII—XIX вв. некоторые учёные предполагали, что основой фермента является белок, но эта мысль не была услышана научной общественностью. В 20-х гг. XX в. известный немецкий химик Рихард Мартин Вильштеттер (1872—1942) попытался выяснить химическую природу ферментов. Однако ему удалось выделить слишком малые их количества, и Вильштеттер ошибочно заключил, что ферменты не могут быть отнесены ни к белкам, ни к другим классам органических соединений. В 1926 г. американский биохимик Джеймс Батчеллер Самнер (1887—1955) выделил фермент уреазу в виде белковых кристаллов, но его обвинили в недостаточной чистоте эксперимента. Лишь в 30-х гг., когда соотечественник Самнера Джон Хауард Нортроп (1891 — 1987) один за другим получил кристаллические ферменты пепсин и трипсин, их белковая природа была окончательно признана, а в 50-х гг. — подтверждена рентгеноструктурным анализом.
Пастер неслучайно упорствовал, не желая сводить брожение к обычному катализу. Дело в том, что ферменты сильно отличаются от небиологических катализаторов.
Во-первых, они чувствительны к температуре, как живые существа. Наиболее распространённый температурный режим промышленных катализаторов — от 200 до 500 °С, а молекулы некоторых ферментов повреждаются уже при 40 °С. При 70 °С большинство ферментов полностью теряют каталитические свойства.
Во-вторых, ферменты чрезвычайно чувствительны к кислотности среды. Каждый фермент работает только в узком интервале рН. Пепсин желудочного сока действует при рН 2—3. Кислая среда обеспечивается соляной кислотой — основным компонентом желудочного сока. Оптимальное значение рН большинства внутриклеточных ферментов — около 7. Это — нейтральная среда, которая обеспечивается кровью. В крови здорового человека рН не отличается от среднего значения 7,4 более чем на 0,2. При рН крови ниже 7,0 или выше 7,8 наступает смерть из-за нарушения деятельности ферментов.
В-третьих, ферменты обладают огромной каталитической активностью: они способны ускорять реакции в 1014—1015 (миллион миллиардов) раз (а многие ферментативные реакции в отсутствие ферментов просто не идут). Возможности обычных катализаторов гораздо скромнее. Например, 1 моль фермента алкогольдегидрогеназы за секунду при комнатной температуре способен превратить в уксусный альдегид 720 моль этилового спирта, в то время как 1 моль медного катализатора при 200 °С справляется лишь с 0,1—1 моль спирта. Правда, 1 моль меди весит 64 г, а 1 моль алкогольдегидрогеназы — примерно 84 кг. Но ведь реакция идёт между частицами, а не между килограммами.
С проявлениями деятельности ферментов мы сталкиваемся на каждом шагу. Разрезанное яблоко темнеет на воздухе, оттого что фермент полифенолоксидаза ускоряет окисление находящихся в клетках плода полифенолов — органических веществ, содержащих соединённые с бензольным кольцом гидроксильные группы. Когда ранку заливают перекисью (пероксидом) водорода Н2О2, перекись «вскипает» — бурно разлагается на воду и кислород под влиянием фермента каталазы, находящегося в крови. Каталаза нужна организму для уничтожения пероксида водорода, который образуется в процессе клеточного дыхания.
В пищеварительных соках содержатся десятки ферментов: липазы, разлагающие жиры на глицерин и органические кислоты; протеазы, разрушающие белки, и др. По мере того как пища проходит по желудочно-кишечному тракту, одни ферменты дробят сложные молекулы на мелкие кусочки, другие помещают эти «кирпичики» на клеточные «склады сырья», третьи строят из них вещества, необходимые организму.
Очень важную роль играют ферменты, называемые фосфатазами: они отвечают за гидролиз (т. е. расщепление с участием воды) сложных эфиров фосфорной кислоты. С помощью этих ферментов организм использует энергию, заключённую в углеводах.
Мы обычно не задумываемся над тем, что вся живая природа существует лишь благодаря ферментативному катализу. Электрические разряды и облучение могут вызвать синтез сложных органических молекул, в том числе полимеров, из смеси метана, аммиака, углекислого газа и воды, но не в состоянии «вдохнуть» в них жизнь.
На сегодняшний день известно свыше 2 тыс. ферментов, а сколько ещё неизвестных... Большинство названий ферментов, как это легко заметить, оканчивается на «аза» — так уж учёные договорились их именовать. А вначале обычно ставят название вещества, на которое действует фермент. Исключения составляют только самые «старые» ферменты, открытые ещё до этой договорённости.
В детстве многих удивляют и забавляют метаморфозы с дрожжевым тестом. Коричневую массу — дрожжи разводят молоком, «подкармливают» сахаром, замешивают с мукой и, заботливо укрыв полотенцем, ставят в тёплое место, а там... Прислушаешься: время от времени будто лопаются пузырьки. Теста становится больше... Оно вылезает из миски!
По «стажу» использования человеком брожение сравнимо разве что с горением древесины. Поэтому неудивительно, что издавна оно привлекало внимание пытливых умов. Пока наши (пра-)nбабки отгоняли наших малолетних (пра-)n-1 дедов от кадушек с тестом, главы семей задумывались над тайной превращения виноградного сусла (ячменного экстракта, табуретки и т. д.) в вино (пиво, эликсир жизни). И те немногие, кто были грамотны, плоды своих размышлений доверяли бумаге.
В трактате знаменитого европейского алхимика Василия Валентина (XV в.) брожение описывается как результат действия некоего духа,...В живых растениях и животных происходят тысячи каталитических процессов между тканями и жидкостями, которые вызывают образование множества разнообразных химических соединений...
Эдуард Бухнер
«Отцами» витамина С можно считать выдающихся английских химиков Эдмунда Ленгли Херста (1898—1975) и Уильяма Н. Хеуорса (1883—1950), которые выделили его в чистом виде и установили его графическую формулу, определив её как g-лактон 2,3-дегидро-L-гулоновой кислоты.
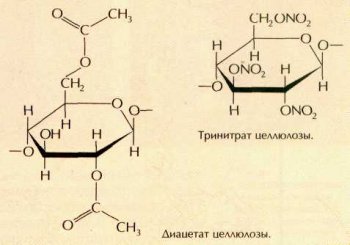
Подобно другим веществам, содержащим гидроксильные группы, целлюлоза вступает в реакцию этерификации с органическими и неорганическими кислотами с образованием сложных эфиров. При этом связи между отдельными фрагментами соединения не разрываются, и возникает полимер, включающий сложно-эфирные группы —COOR—. При взаимодействии целлюлозы с уксусной кислотой или её производными (например, уксусным ангидридом) образуются ацетаты целлюлозы, у которых в каждом звене макромолекулы на эфирные остатки замещены одна, две или три гидроксильные группы.
Ацетаты целлюлозы используются в производстве синтетических волокон (ацетатного волокна).
При нитровании целлюлозы смесью дымящей азотной и концентрированной серной кислот образуется тринитрат целлюлозы, который применяют для приготовления бездымного пороха (пироксилина).
Динитрат целлюлозы служит основным компонентом целлулоида — пластмассы, из которой делают некоторые типы искусственных стёкол.
Бумага (от персидск. «бомбака» — «хлопок») представляет собой материал, состоящий из тонко переплетённых между собой волокон целлюлозы. Отдельные волокна связаны друг с другом посредством водородных связей, которые возникают между гидроксильными группами.
Бумага была изобретена в конце II в. до н. э. в Китае, где её получали из волокон хлопка и бамбука. В VIII в. н. э. секрет изготовления бумаги стал известен арабам, а в IX в. его переняли византийцы.
В Средние века для изготовления бумаги использовали хлопок, пеньку, а также старое тряпьё — хлопковые и льняные ткани. На специальных мельницах их превращали в порошок, который размешивали в воде для получения густой однородной массы. Лишь в XVIII в. было обнаружено, что удобным исходным веществом для производства бумаги может служить древесина. А первые заводы по переработке древесины в целлюлозу появились только в XIX столетии.
Сахар, который вы кладёте в чашку чая или кофе, скорее всего, из сахарной свёклы. Но он мог быть выработан и из сладкого сока других растений. Во многих странах этот продукт получают из сахарного тростника. Хотя с химической точки зрения свекловичный сахар и тростниковый — одно и то же вещество, у них всё же есть отличия. Обнаружить их можно лишь с помощью чувствительного прибора, позволяющего определять соотношение изотопов углерода в образце. В природе углерод встречается в виде двух стабильных изотопов — 12С и 13С, содержание которых, соответственно, 98,892 и 1,108%.
Различие в массах изотопов углерода достаточно велико — около 8 %, и это сказывается на скоростях некоторых химических реакций, идущих в живых организмах. Например, при фотосинтезе растения, поглощая из воздуха углекислый газ, отдают предпочтение более лёгкому изотопу 12С, поэтому во всех живых организмах и продуктах их разложения (угле, торфе, нефти) содержание тяжёлого изотопа 13С немного понижено, тогда как в углекислом газе и карбонатах морского происхождения (известняк из раковин) — повышено.
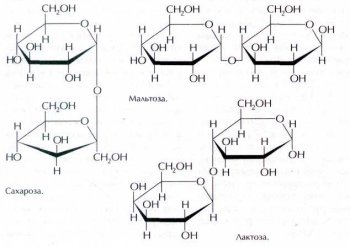
Сахароза (свекольный или тростниковый сахар) С12Н22О11 представляет собой дисахарид, образованный из остатков a-глюкозы и b-фруктозы (в форме полуацеталей), связанных друг с другом. Однако в отличие от этих моносахаридов сахароза не проявляет в растворе восстановительных свойств — не восстанавливает оксид серебра и гидроксид меди (II). В кислой среде сахароза гидролизуется — разлагается водой на глюкозу и фруктозу. Вот самый простой пример: сладкий чай кажется ещё более сладким, если положить в него ломтик лимона, хотя, конечно, и кислым одновременно. Это происходит благодаря присутствию лимонной кислоты, которая ускоряет распад сахарозы на глюкозу и фруктозу.
При внесении сахарозы в раствор медного купороса в присутствии щёлочи образуется ярко-синий сахарат меди — вещество, в котором атомы металла связаны с гидроксильными группами углевода.
Молекулы одного из изомеров сахарозы — мальтозы (солодового сахара) состоят из двух остатков глюкозы. Этот дисахарид образуется в результате ферментативного гидролиза крахмала. В молоке многих млекопитающих содержится другой дисахарид, изомерный сахарозе, — лактоза (молочный сахар). По интенсивности сладкого вкуса лактоза значительно (в три раза) уступает сахарозе.