Аминокислоты, как правило, имеют исторические названия — по источнику, из которого они впервые были выделены. Например, аспарагин обнаружили в 1806 г. в соке аспарагуса (спаржи), а глутаминовую (от лат. gluten — «клей») кислоту — в клейковине пшеницы. Цистеин (от греч. «цистис» — «пузырь») был впервые выделен в 1810 г. из камней мочевого пузыря. При изучении молочного белка казеина был открыт тирозин (от греч. «тирос» — «сыр»). Аргинин (от лат. argentum — «серебро») был впервые получен в виде соли серебра. Глицин назван так за сладкий вкус (от греч. «гликис» — «сладкий»). Название «лейцин» произошло от греческого слова «лейкос» — «белый»: в яичном белке это одна из самых распространённых аминокислот. Лизин получил своё название от одного из значений греческого слова «лизис» — «растворение», «разрушение», благодаря очень хорошей растворимости в воде. Некоторые аминокислоты были получены из белков шёлкового волокна, например гистидин (от греч. «гистос» — «ткань») и серии (от лат. sericus— «шёлковый»).
В начале 50-х гг. XX в. американские химики Лайнус Карл Полинг (1901 — 1994), награждённый Нобелевской премией за исследования природы химической связи, и Роберт Кори
*Молекулярную массу белков иногда выражают в дальтонах (Да). Дальтон — это единица массы, тождественная углеродной единице.
Лайнус Карл Полинг.
При гидролизе белков до аминокислот (разрушении пептидной связи водой) теряется информация о последовательности их соединения. Поэтому долгое время считали, что определение первичной структуры белка представляет собой совершенно безнадежную задачу. Но в 50-х гг. XX в. английский биохимик Фредерик Сенгер (родился в 1918 г.) смог расшифровать последовательность аминокислот в полипептидных цепях гормона инсулина. За эту работу, на выполнение которой ушло несколько лет, в 1958 г. Сенгер был удостоен Нобелевской премии по химии (двадцатью годами позже он совместно с У. Гилбертом получил вторую премию за вклад в установление первичной структуры ДНК).
Принципы определения аминокислотной последовательности, впервые сформулированные Сенгером, используются и ныне, правда, со всевозможными вариациями и усовершенствованиями. Процедура установления первичной структуры белка сложна и многоступенчата: в ней около десятка различных стадий. Сначала белок расщепляют до отдельных аминокислот и устанавливают их тип и количество в данном веществе. На следующей стадии длинную белковую молекулу расщепляют уже не полностью, а на фрагменты. Затем в этих фрагментах определяют порядок соединения аминокислот, последовательно отделяя их одну за другой. Расцепление белка на фрагменты проводят несколькими способами, чтобы в разных фрагментах были перекрывающиеся участки. Выяснив порядок расположения аминокислот во всех фрагментах, получают полную информацию о том, как аминокислоты расположены в белке. К концу XX в. созданы специальные приборы, определяющие последовательность аминокислот в молекуле белка в автоматическом режиме — секвенаторы (от англ. sequence — «последовательность»).
D- и L-формы аминокислот обладают способностью очень медленно превращаться друг в друга. За определённый (весьма длительный) период времени чистая D- или L-форма может стать смесью равных количеств обеих форм. Такая смесь называется рацематом, а сам процесс — рацемизацией. Скорость рацемизации зависит от температуры и типа аминокислоты. Данное свойство можно использовать для определения возраста ископаемых остатков организмов, а при необходимости — и живых существ. Например, в белке дентина (дентин — костная ткань зубов) L-a-парагиновая кислота самопроизвольно рацемизуется со скоростью 0,1% в год. У детей в период формирования зубов в дентине содержится только L-аспарагиновая кислота. Дентин выделяют из зуба и определяют в нём содержание D-формы. Результаты теста достаточно точны. Так, для 97-летней женщины, возраст которой был документально засвидетельствован, тест показал возраст 99 лет. Данные исследований, выполненных на ископаемых остатках доисторических животных — слонов, дельфинов, медведей, — хорошо согласуются с результатами датирования, полученными радионуклидным методом.
* Приведена формула для всей аминокислоты.
** R-группа глицина представляет собой просто атом водорода, и эту аминокислоту трудно отнести к какому-нибудь из четырех классов. Такая боковая группа не может нести ни положительный, ни отрицательный заряд, не способна участвовать во взаимодействиях неполярных R-групп (гидрофобных взаимодействиях) или образовании водородных связей. Но у глицина, входящего в состав аминокислотной цепочки, как и у всех других аминокислот, есть две полярные группы — >С=О и >N—Н. Поэтому глицин условно можно отнести к полярным аминокислотам.
В каждой молекуле аминокислоты есть атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — карбоксильная группа —СООН. Она легко «отпускает на волю» ион водорода Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — аминогруппа —NH2, и, наконец, четвёртый заместитель — группа атомов, которую в общем случае обозначают R. У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль.
Свойства «бусинок», отличающие одну аминокислоту от другой, скрыты в R-группах (их ещё называют боковыми цепями). Что же касается группы —СООН, то химики-органики относятся к ней с большим почтением: всем другим атомам углерода в молекуле даются обозначения в зависимости от степени их удалённости от карбоксильной группы. Ближайший к ней атом именуют a-атомом, второй — b-атомом, следующий — g-атомом и т. д. Атом углерода в аминокислотах, который находится ближе всех к карбоксильной группе, т. е. a-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют a-аминокислотами.
Молекула белка очень длинная. Химики называют такие молекулы полимерными (от греч. «поли» — «много» и «мерос» — «часть», «доля»). Действительно, длинная молекула полимера состоит из множества маленьких молекул, связанных друг с другом. Так нанизываются на нить бусинки в ожерелье. В полимерах роль нити играют химические связи между бусинками-молекулами.
Секрет белков спрятан в особенностях этих самых бусинок. Большинство полимеров не принимает устойчивой формы в пространстве, уподобляясь тем же бусам, у которых и не может быть пространственной структуры: повесишь их на шею — они примут форму кольца или овала, положишь в коробку — свернутся в клубок неопределённой формы. А теперь представим себе, что некоторые бусинки могут «слипаться» друг с другом. Например, красные притягиваются к жёлтым. Тогда вся цепочка примет определённую форму, обязанную своим существованием «слипанию» жёлтых и красных бусинок.
Более 4 млрд. лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными блоками живых организмов. Своим бесконечным разнообразием всё живое обязано именно уникальным молекулам белка, и иные формы жизни во Вселенной науке пока неизвестны.
Разнообразие функций, выполняемых встречающимися в природе белками, огромно.
Белки, или протеины (от греч. «протос» — «первый»), — это природные органические соединения, которые обеспечивают все жизненные процессы любого организма. Из белков построены хрусталик глаза и паутина, панцирь черепахи и ядовитые вещества грибов... С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глубинах океана мерцают таинственным светом медузы.
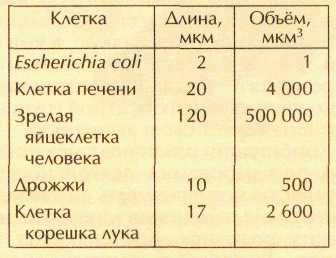
Очень давно, приблизительно 1,5 млрд. лет назад, природа совершила скачок в развитии — произошёл переход от маленьких клеток с простой структурой к большим по размерам и значительно сложнее устроенным клеткам. Эти высокоорганизованные клетки называют эукариотическими (от греч. «эу» — «хорошо», «полностью» и «карион» — «ядро ореха»). Высшие организмы в отличие от бактерий состоят из эукариотических клеток. Сравнить размеры прокариотических и эукариотических клеток можно с помощью таблицы:
Бактерии и синезелёные водоросли относятся к простейшим одноклеточным организмам. Однако с точки зрения химии даже мельчайшая клетка чрезвычайно сложна.
Так получилось, что среди бактерий наиболее изученной оказалась кишечная палочка Escherichia coli (сокращённо Е. coli) — безобидный обитатель кишечного тракта человека и животных. И хотя размеры «лучшего друга» биохимиков гораздо меньше размеров любой растительной или животной клетки (длина 2 мкм, диаметр 0,8 мкм, а объём около 1 мкм3; 1 мкм = 10-6 м), а масса составляет всего 2•10-12 г, для химиков это огромный объект: ведь масса Е, coli в 60 млрд. раз превосходит массу молекулы воды! А за всем этим скрывается высокоорганизованный комплекс большого числа молекул.
Бактериальная клетка защищена жёсткой полисахаридной оболочкой — клеточной стенкой. Она предохраняет клетку от набухания и разрыва из-за разницы в концентрации низкомолекулярных веществ внутри клетки и вне её (внутри клетки концентрация низкомолекулярных веществ значительно выше, чем снаружи). Клетка также окружена состоящей из липидов полупроницаемой клеточной мембраной, которая определяет размер клетки. Кроме того, мембрана служит своего рода фильтром: она контролирует поступление внутрь клетки питательных веществ и выход наружу продуктов её жизнедеятельности. Способность мембраны регулировать перемещение веществ и тем самым поддерживать в клетке нужную концентрацию ионов и органических молекул является жизненно важной.
В процессе промышленного получения химических веществ очень часто требуются высокие температура и давление. А иногда нужны особые условия, например присутствие сильных кислот или щелочей, а то и вовсе электрические разряды. И это для получения какой-нибудь простой молекулы, в которую атомы не хотят так просто объединяться! А в живой клетке каждую секунду протекают сотни и тысячи всевозможных химических реакций. И происходит это в исключительно «мягких», как говорят химики, условиях: при температуре всего лишь в несколько десятков градусов по Цельсию, атмосферном давлении и в нейтральной среде. Конечно, «жёстких» условий, свойственных промышленным процессам, хрупкие и нестабильные молекулы, из которых построены компоненты клеток, не выдержали бы. И тем не менее, как же клеткам удаётся проводить химические реакции, не прибегая к высоким температуре и давлению?
Работа «химической лаборатории» клеток возможна только благодаря тому, что они содержат уникальные катализаторы, которые могут значительно ускорять химические реакции. Это особые катализаторы — белковые молекулы, называемые ферментами.
Процветание различных форм жизни в значительной степени объясняется тем, что клетки способны образовывать большое количество ферментов. Ферменты не только обеспечивают протекание реакций в «мягких» условиях. Главное, что в их присутствии сложные многостадийные реакции могут происходить мгновенно.
Для правильной работы систем клетки необходима их чёткая организация. Поэтому природа придумала хитрый механизм, который позволяет управлять процессом группировки молекул.
Обычные ковалентные связи для объединения макромолекул не подходят, ведь атомы, связанные ковалентной связью, становятся частями одной молекулы. Если представить организацию макромолекул в клетке с помощью ковалентных связей, получится, что клетка — одна гигантская макромолекула! Кроме того, ковалентные связи слишком прочны — настоящий «стальной трос». Для огромных неповоротливых громадин вроде белков или нуклеиновых кислот нужно нечто совсем иное — подобие тонкой рыболовной сети. Такая «сеть» надёжно удержит молекулы вместе и одновременно предоставит им некоторую свободу, необходимую для выполнения их функции.


