О соотношении химии и математики, помимо Канта, высказался также французский учёный Огюст Конт, основатель философии позитивизма и автор формальной классификации наук. И причём высказался прямо противоположным образом. «Любую попытку применить математические методы при изучении химических вопросов, — писал Конт в 1830 г., — следует рассматривать как абсолютно неразумную и противоречащую духу химии... Если когда-нибудь математический анализ займёт в химии видное место — что, к счастью, почти невозможно, — то это приведёт к быстрому и полному вырождению этой науки».
Для нас высказывание Конта звучит более чем странно, но два столетия назад многие химики нетвёрдо знали даже... четыре правила арифметики. Доказательством может служить труд Рихтера «Начальные основания стехиометрии», в котором он объясняет своим коллегам: «Если одно число прибавляется к другому, то между ними следует поместить знак „+" (который называется плюсом), если же мы хотим произвести вычитание, то между ними ставится знак „-" (который называется минусом). Например, 19 + 424 Означает, что мы прибавляем 19 к 424, что даёт 443; а запись 424 - 19 означает, что мы отнимаем 19 от 424, что даёт 405»
Выдающийся немецкий философ Иммануил Кант как-то заметил, что в некоторых ветвях естественных наук истинной науки столько, сколько в них математики. Эти слова произвели глубокое впечатление на немецкого химика Иеремию Вениамина Рихтера (1762—1807): даже свою докторскую диссертацию он назвал «Использование математики в химии». А ещё Рихтер сформулировал правило, которым химики пользуются уже более двух столетий. Основываясь на результатах собственных экспериментов, а также работ предшественников, он вывел закон, согласно которому вещества взаимодействуют в строго определённых соотношениях, причём массы и исходных веществ, и продуктов реакции можно рассчитать заранее. Впервые в истории химии Рихтер записал количественные уравнения реакций, позволяющие, как выразился бы современный химик, рассчитать теоретический выход продукта.
Все эти идеи, известные сейчас даже школьнику, Рихтер изложил в 1793 г. в своём главном труде «Начальные основания стехиометрии». Введённое им понятие стехиометрии (от греч. «стойхеон» — «основание», «элемент» и «метрео» — «измеряю»), т. е. массовых или объёмных соотношений реагирующих веществ, стало одним из ключевых в химии.
Плазма — электрически нейтральный, сильно ионизированный газ, состоящий из положительно заряженных ионов, электронов и нейтральных молекул. Во многих отношениях плазма ведёт себя как обычный газ и подчиняется законам газовой динамики.
Чтобы превратить газ в плазму (ионизировать его), нужно затратить большую энергию, которая называется энергией ионизации. Легче всего ионизируются пары щелочных металлов (энергия ионизации цезия — 375 кДж/моль), труднее всего — благородные газы (для гелия энергия ионизации равна 2372 кДж/моль). Плазма возникает в разрядах молний, в пламени. Верхние слои атмосферы Земли также представляют собой плазму, образовавшуюся под действием солнечного излучения.
Плазму можно создавать искусственно, подвергая нейтральный разреженный газ действию электрического поля (как в лампах дневного света) или очень высоких температур.
Звёзды состоят из высокоионизированной плазмы, в которой атомы теряют уже не один внешний, а все электроны, для чего требуются колоссальные температуры. Так, для потери атомом бериллия одного электрона необходима энергия 900 кДж/моль, чтобы оторвать второй электрон, нужно уже 17бО кДж/моль, третий — 14 850 кДж/моль, а четвёртый (и последний) — 20 900 кДж/моль! Чтобы атомы при столкновениях имели такую кинетическую энергию, вещество надо нагреть почти до 2 млн. градусов.
Однако до сегодняшнего дня никто не замечал, чтобы оконное стекло стекало в сторону подоконника. Если бы стекло хоть в малейшей степени было текучим, люди не могли бы строить современные мощные оптические телескопы, такие, например, как самый крупный в мире телескоп в чилийской пустыне Атакама, названный «Очень большим оптическим». Диаметр его зеркала 8,2 м. Точность шлифовки зеркала исключительно высока, малейшие деформации стекла недопустимы.
С другой стороны, при исследовании средневековых витражей, изготовленных из цветных стёкол, выяснилось: в нижней части они толще, чем в верхней. Некоторые учёные сделали вывод, что это следствие очень медленного, на протяжении многих веков, течения стекла под действием собственного веса, и даже предложили использовать данное свойство для установления времени изготовления старинных стёкол. У химиков существовало поверье, что длинные стеклянные трубки и палочки нельзя долго хранить в вертикальном положении, так как они постепенно изгибаются. Об этом можно было прочитать ещё в начале XX в. в книге известного немецкого учёного, лауреата Нобелевской премии по химии Вильгельма Оствальда (1853—1932) «Физико-химические исследования».
В твёрдом веществе каждая молекула удерживается межмолекулярными силами в определённом положении относительно своих соседей. Твёрдые тела обладают очень малой сжимаемостью, поскольку доля свободного объёма в них обычно ещё меньше, чем в жидкостях. Так что плотность данного вещества в твёрдом состоянии, как правило, больше, чем в жидком. Одним из исключений является вода, плотность которой при нормальном давлении выше плотности льда.
Большинство твёрдых веществ находится в кристаллической форме: их частицы — молекулы, атомы или ионы — расположены в строгом порядке, образуя регулярную пространственную структуру — кристаллическую решётку. Поэтому при переходе жидкости в твёрдое состояние молекулы ведут себя подобно солдатам, получившим команду к построению.
Вместе с тем частицы в кристаллической решётке не неподвижны, они постоянно совершают колебательные движения. Если частицы, расположенные на поверхности твёрдого вещества, приобретают энергию, достаточную для преодоления силы притяжения остальных частиц в кристалле, то они «улетают», образуя пар. Все твёрдые вещества имеют определённое давление пара, хотя оно обычно очень мало, особенно для ионных кристаллов. Так, для NaCl давление пара, равное всего 0,001 мм рт. ст.
Жидкости занимают промежуточное положение между газами и твёрдыми веществами. Силы взаимного притяжения молекул в жидкостях достаточно велики, чтобы удерживать молекулы вместе, так что, в отличие от газов, жидкости имеют постоянный объём. В то же время эти силы недостаточны, чтобы держать молекулы в жёсткой упорядоченной структуре, и потому у жидкостей нет постоянной формы.
Если в газах доля свободного объёма составляет более 99%, то в жидкостях — обычно лишь около 3%. То есть плотности жидкостей значительно выше и приближаются к плотностям твёрдых тел. Поскольку молекулы жидкого вещества уже находятся в довольно тесном контакте, сжимаемость жидкостей на много порядков ниже, чем газов.
Во внутреннем объёме жидкости молекулы имеют максимально возможное число «соседей», а на поверхности образуют меньше связей и потому обладают избытком энергии. Этим обусловлено одно из важнейших свойств жидкости — поверхностное натяжение: жидкость всегда стремится уменьшить свою поверхность. Вот почему свободно падающая жидкость принимает форму капли, а в невесомости — форму шара, поверхность которого при данном объёме минимальна.
Газ превращается в жидкость, когда энергия взаимного притяжения молекул превышает их кинетическую энергию (энергию движения). Так как силы межмолекулярного притяжения становятся значимыми только при малых расстояниях между молекулами, сжижению, или конденсации (от лат. condensatio — «сгущение», «уплотнение»), способствует повышение давления. Кроме того, к сжижению ведёт понижение температуры, поскольку кинетическая энергия молекул при этом уменьшается.
Итак, если температуру не снижать, то для конденсации газа необходимо значительное повышение давления. Чем выше температура, тем большее давление надо приложить. В конце концов можно достичь такой температуры, при которой газ невозможно перевести в жидкое состояние ни под каким давлением. Самая высокая температура, при которой газ ещё удаётся превратить в жидкость повышением давления, называется его критической температурой. Соответственно, давление, необходимое для сжижения газа при критической температуре, называется критическим давлением. Критические температура и давление вещества зависят от сил межмолекулярного притяжения, поэтому они индивидуальны для каждого вещества и являются его характеристическими постоянными.
При температурах выше критической вещество находится в особом состоянии. Оно полностью занимает объём сосуда, что свойственно газам. Однако плотность его может быть значительно выше, чем у газов. Поэтому для данной фазы обычно используют название сверхкритический флюид (от лат. fluidus — «текучий»).
Газы не имеют собственной формы и объёма и, как правило, смешиваются друг с другом в любых соотношениях (если, конечно, между ними не идёт химическая реакция). Эти свойства газов обусловлены тем, что молекулы в них находятся далеко друг от друга. Доля свободного объёма, т. е. пространства, не занятого самими молекулами, в газах при нормальных условиях (атмосферном давлении и температуре 0 °С) составляет более 99%. В этом объёме молекулы газов хаотически движутся с большой скоростью, постоянно сталкиваясь друг с другом. Собственно, само слово «газ» происходит от греческого «хаос»; этот термин ввёл в XVII в. нидерландский естествоиспытатель Ян Баптист ван Гельмонт (1579—1644).
При небольших давлениях межмолекулярными взаимодействиями в газах можно пренебречь, т. с. разные газы ведут себя практически одинаково (если говорить о физических, а не химических свойствах). Такое состояние газа называется идеальным и описывается уравнением, связывающим его давление р, объём V, число молей n и температуру Т: pV = nRT, где R — универсальная газовая постоянная (R = 8,31 Дж/(моль•К)=0,082 (л•атм)/(моль • К)).
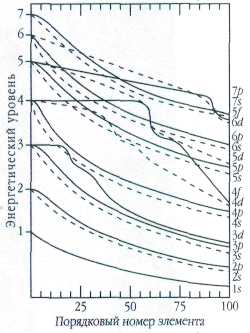
Изменение энергии орбиталей в зависимости от порядкового номера элемента.
Почему же удивительно стройная атомистическая гипотеза древних долго не получала признания? Учение Демокрита и других атомистов натолкнулось на ожесточённое сопротивление Аристотеля. Он показал, что неизбежное для учения об атомах понятие пустоты несёт в себе логическое противоречие: ведь пустота — это «ничто», а как может быть то, чего не существует? Следовательно, пустоты в мире нет, это — абстракция, лишённая смысла. «Natura abhorret vacuum» — «природа не терпит пустоты» {лат.). Данный постулат в течение многих столетий был основой так называемой аристотелевой физики. Из-за огромного авторитета Аристотеля атомная гипотеза строения материи два тысячелетия оставалась на задворках науки...
Вероятно, древнегреческие мыслители первыми высказали предположение о том, что материальный мир един, а потому познаваем. Фалес (около 625 — около 547 до н. э.), наблюдая за различными превращениями веществ, пришёл к выводу, что все они являются разновидностями одного «первичного элемента» — начала всех веществ. Таким элементом Фалес считал воду. Анаксимен (VI в. до н. э.) называл первичным элементом воздух, Гераклит (VI—V вв. до н. э.) — огонь. Аристотель (384-^322 до н. э.) развивал учение о четырёх первоначалах — огне, воздухе, воде и земле. Элементы он считал не материальными субстанциями, подобными обычной воде или земле, а лишь носителями определённых качеств, которыми наделены все тела. Эти качества — теплота, холод, сухость и влажность.
Иначе подошли к учению о строении материи Левкипп (V в. до н. э.) и его ученик Демокрит. Их занимал вопрос о её делимости на всё более мелкие частицы — конечен ли этот процесс или бесконечен? Если деление можно продолжать как угодно долго, значит, материя непрерывна, и её структура принципиально не меняется при любом «увеличении». Если же деление нельзя продолжать бесконечно, рано или поздно мы дойдём до мельчайшей частички, которую Демокрит назвал атомом, что в переводе и означает «неделимый». Тут предполагалась дискретность (от лат. discretus — «прерывистый») материи: между мельчайшими её частичками — пустота.
Многочисленные эксперименты, проведённые физиками в начале XX в.. показали, что атомы состоят из ядер, вокруг которых движутся электроны — в этом отношении атомы напоминают Солнечную систему. Недаром модель атома, предложенную в 1911 г. английским физиком Эрнестом Резерфордом (1871 — 1937), назвали планетарной. Действительно, в Солнечной системе почти вся масса (99,87 %) сосредоточена в центральном светиле, а на планеты приходятся лишь сотые доли процента. Оказывается, в атомах тоже практически вся масса сосредоточена в ядре (в частности, в атоме водорода — 99,95 %).
Но если сравнивать не массы, а размеры, то окажется, что атом намного более «пустой», чем Солнечная система. Её диаметр примерно в 4 тыс. раз больше диаметра Солнца. Размеры же атомов (порядка 10-10 м) приблизительно в 100 тыс. раз превышают размеры ядра (порядка 10-15 м для лёгких ядер)! Если увеличить ядро до 1 мм (булавочная головка), то сам атом вырастет до 100 000 мм = 100 м (размер футбольного поля). Ещё разительнее сопоставление объёмов ядра и атома — получается разница в 15 порядков. Это означает, например, что практически вся масса огромного свинцового куба с ребром 100 м (она равна 11 млн. тонн) сосредоточена в ядрах атома свинца, суммарный объём которых меньше спичечной головки! Трудно даже представить себе, насколько высока плотность ядерного вещества.
Современные понятия элемента, атома и простого вещества, молекулы как совокупности связанных между собой атомов сформировались сравнительно недавно. Но атомистическая теория строения материи — учение о том, что все вещества состоят из мельчайших частиц, — прошла долгий и трудный путь.
Догадки древних, основанные лишь на размышлениях, в принципе, не так уж далеки от нынешних представлений: существуют определённые типы атомов (элементы), которые могут по-разному соединяться друг с другом, давая огромное разнообразие веществ с несхожими свойствами. Такое учение было величайшим достижением человеческого разума. Очень образно об этом сказал американский физик, лауреат Нобелевской премии Ричард Фейнман: «Если бы в результате какой-то мировой катастрофы все накопленные научные знания оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это — атомная гипотеза (можно называть её не гипотезой, а фактом, но это ничего не меняет): все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому. В одной этой фразе... содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».