Многочисленные эксперименты, проведённые физиками в начале XX в.. показали, что атомы состоят из ядер, вокруг которых движутся электроны — в этом отношении атомы напоминают Солнечную систему. Недаром модель атома, предложенную в 1911 г. английским физиком Эрнестом Резерфордом (1871 — 1937), назвали планетарной. Действительно, в Солнечной системе почти вся масса (99,87 %) сосредоточена в центральном светиле, а на планеты приходятся лишь сотые доли процента. Оказывается, в атомах тоже практически вся масса сосредоточена в ядре (в частности, в атоме водорода — 99,95 %).
Но если сравнивать не массы, а размеры, то окажется, что атом намного более «пустой», чем Солнечная система. Её диаметр примерно в 4 тыс. раз больше диаметра Солнца. Размеры же атомов (порядка 10-10 м) приблизительно в 100 тыс. раз превышают размеры ядра (порядка 10-15 м для лёгких ядер)! Если увеличить ядро до 1 мм (булавочная головка), то сам атом вырастет до 100 000 мм = 100 м (размер футбольного поля). Ещё разительнее сопоставление объёмов ядра и атома — получается разница в 15 порядков. Это означает, например, что практически вся масса огромного свинцового куба с ребром 100 м (она равна 11 млн. тонн) сосредоточена в ядрах атома свинца, суммарный объём которых меньше спичечной головки! Трудно даже представить себе, насколько высока плотность ядерного вещества.
Ядра всех элементов состоят из положительно заряженных протонов (р от греч. «протос» — «первый») и
не имеющих заряда нейтронов (n; от лат. neutrum — «ни то, ни другое»). Только ядро атома водорода состоит из единственного протона. Число протонов в ядре (Z) определяет атомный номер химического элемента (под этим номером он и числится в периодической системе), а сумма протонов и нейтронов называется массовым числом (А); очевидно, что оно всегда целое. Протоны и нейтроны имеют общее название — нуклоны (от лат. nucleus — «ядро»). Термином нуклид обозначают атом с определённым атомным номером Z и массовым числом А, т. е. с определённым набором протонов и нейтронов. Нуклиды с одним и тем же атомным номером, но с разными массовыми числами называются изотопными нуклидами или просто изотопами (от греч. «изос» — «равный» и «топос» — «место»). Другими словами, в ядрах всех изотопов данного элемента содержится одинаковое число протонов, но разное число нейтронов.
Нуклиды обозначают символом элемента и массовым числом: 12С, 14N, l6O; другая форма записи: углерод-12, азот-14, кислород-16. Если массовое число не указывать, то подразумеваются все природные изотопы данного элемента. Иногда указывают и атомный номер элемента, но это не обязательно, поскольку символ элемента однозначно связан с определённым Z. Так, для атомов водорода Z=1, для азота Z=7, для кислорода Z=8 и т. д. Разных нуклидов значительно больше, чем элементов. Например, в природе найдены три
изотопа водорода — нуклиды 1Н, 2Н (другое обозначение D — дейтерий) и 3Н (или Т — тритий), три изотопа углерода (12С, 13С и 14С), четыре — серы, пять — кальция, шесть — селена, семь — молибдена, восемь — кадмия, девять — ксенона и десять — олова (это рекорд). Есть и элементы-одиночки, представленные всего одним нуклидом: 9Ве, 19F, 23Na, 27Al, 31P и др. Некоторые природные нуклиды нестабильны: со временем они распадаются; это — радионуклиды (см. статью «Превращения атомных ядер»).
Если атом нейтрален, его положительно заряженное ядро удерживает столько же отрицательно заряженных электронов (е), сколько протонов в ядре. Электроны в атомах формируют оболочки, называемые также энергетическими уровнями. Из всех возможных способов расположения электронов в атоме данного элемента реализуется тот, при котором энергия атома, т. е. системы «ядро — электроны», является минимальной. Чем ближе к ядру расположены электроны, чем больше сила притяжения между ними и ядром, тем меньше суммарная энергия атома. А по мере увеличения числа электронов они стремятся расположиться подальше друг от друга, что уменьшает взаимное отталкивание электронов и также снижает энергию атома. При расчёте полной энергии атома следует учитывать оба эти фактора. Неудивительно, что подобные расчёты представляют собой очень сложную задачу.
Электрон движется около ядра в определённом пространстве, которое называется атомной орбиталью. Орбитали могут иметь разную форму — шарообразную (s-орбиталь), гантелеобразную (p-орбиталь) или более сложную (d-, f-орбитали и т. д.), В этом отношении между движением планет вокруг Солнца и движением электронов около ядра нет ничего общего: электроны подчиняются другим (квантовым) законам. На каждой орбитали могут одновременно находиться максимум два электрона, обладающие противоположными спинами (спин — собственная характеристика электрона, имеющая квантовую при
роду). Графически орбитали часто изображают в виде ячеек, а находящиеся на них электроны — стрелками (стрелки, направленные в разные стороны указывают на противоположные спины двух электронов).
Для первого, самого нижнего энергетического уровня (K-оболочка) возможна только s-орбиталь, для второго (L-оболочка) —s и p, для третьего (М-оболочка) — s, p и d и т. д. Для изолированного атома орбитали с одинаковой формой и энергией образуют энергетические подуровни (подслои). Их обозначают, указывая номер уровня и характер орбитали, скажем 2s, 4f Справа вверху указывают число электронов на данной орбитали, например 1s1 (у атома водорода) или 5d10 (у атома золота). На каждом подуровне может поместиться строго определённое число электронов: на s-подуровне — 2 (он состоит из одной s-орбитали), на p-подуровне — 6 ( три p-орбитали: рх, ру, pz), на d-подуровне — 10 (пять d-орбиталей: dxy, dxz, dyz, 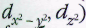 , а на f-подуровне — 14 (семь f-орбиталей). При последовательном заполнении подуровней электроны
, а на f-подуровне — 14 (семь f-орбиталей). При последовательном заполнении подуровней электроны
ведут себя примерно так, как пассажиры, входящие в пустой автобус: они вначале рассаживаются на сиденьях по одному, и лишь когда все места у окошек заняты, начинают занимать соседние.
Энергия данной орбитали не постоянна: она снижается (причём не всегда плавно) при переходе от более лёгких к более тяжёлым атомам. Это объясняется тем, что для лёгких атомов энергия данного уровня определяется в основном притяжением электронов к ядру, тогда как для тяжёлых атомов велико влияние взаимного отталкивания электронов. В результате происходит как бы соревнование между разными энергетическими уровнями.
Эта особенность позволяет понять ряд «исключений» в размещении электронов по энергетическим уровням и подуровням некоторых элементов. Всё это очень важно для объяснения химических свойств элементов: ведь именно перестройка электронных орбиталей при сближении атомов и составляет сущность химической реакции.
Форма атомных орбиталей.

Похожие статьи