Рассмотрим образование простейшего молекулярного иона H+2; Н+Н+ ® H+2.
Сравним его энергию с энергией исходных частиц. Если исходные частицы Н и Н+ пребывают в состоянии покоя на большом расстоянии друг от друга, то общая энергия складывается из кинетической энергии электрона в атоме Н и потенциальной энергии его притяжения к ядру атома.
Если приблизить частицы Н и Н+ друг к другу, то появятся два новых источника энергии: электрон станет притягиваться также к чужому ядру, у которого нет своего электрона, а два ядра будут отталкиваться друг от друга. Первый процесс уменьшает общую энергию, второй — увеличивает её.
По мере сближения Н и Н+ общая энергия системы сначала уменьшается — до тех пор, пока притяжение электрона к чужому ядру играет главную роль. При расстоянии между ядрами 0,106 нм общая энергия системы становится минимальной. Дальнейшее сближение ядер приводит к их сильному отталкиванию и, как следствие, к значительному увеличению общей энергии.
Выигрыш в энергии по сравнению с изолированными частицами составляет 268 кДж/моль, причём основной вклад вносит притяжение электрона к чужому ядру. Это и есть энергия химической связи в молекуле.
Итак, главный результат образования химической связи — уменьшение общей энергии системы ядер и электронов, а достигается он путём совместного использования электронов разными ядрами. Тем самым подтверждается гениальная догадка Томсона о том, что главную роль в химической связи играют электроны.
Если сближать друг с другом два атома гелия (электронная конфигурация 1s2), общая энергия всё время повышается: при любом расстоянии она больше, чем сумма энергий изолированных атомов. Это означает, что молекула Не2 из таких атомов образоваться не может.
Если же один из атомов возбудить и перевести 1s-электрон на 2s-ypoвень, то такой атом способен соединиться с невозбуждённым во вполне устойчивую (с энергетической точки зрения) молекулу. Правда, молекула в возбуждённом состоянии живёт недолго: примерно через 10-8 секунд после образования она испустит квант света и перейдёт в основное состояние, в результате чего немедленно распадётся на атомы.
Молекулы, которые могут существовать только в возбуждённом состоянии, называют эксимерами (от лат. excito— «возбуждаю»). К ним относятся многие двухатомные молекулы, например Не2, Ne2, Ar2, XeF, KrF, Hg2. Энергия, выделяющаяся при электронных переходах в подобных молекулах, используется в мощных эксимерных лазерах, работающих в ультрафиолетовом и видимом диапазоне.
В 1957 г. канадский физикохимик Роналд Джеймс Гиллеспи создал простую, но красивую теорию, которая позволяет с хорошей точностью по структуре Льюиса предсказывать геометрическую форму молекул.
Согласно этой теории, во многих простых молекулах химические связи расположены таким образом, что электронные пары, принадлежащие одному атому, максимально удалены друг от друга.
Например, в молекуле ВеН2 атом бериллия делит с атомами водорода две пары электронов. Одна пара максимально удалена от другой, когда угол между связями составляет 180°. Это означает, что молекула линейна.
Теория даёт возможность установить геометрическое строение молекул типа AXnEm, где к центральному атому А присоединены n атомов X и имеется также т неподелённых электронных пар (что обозначено символом Еm). Общее число электронных пар m+n составляет от двух до восьми.
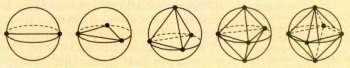
Чтобы определить максимально удалённое расположение электронных пар, можно представить каждую пару точечным зарядом на поверхности сферы, в центре которой находится атом, и найти максимум суммы расстояний между этими зарядами.
Расположение точек на поверхности сферы, при котором они максимально удалены друг от друга.
Классическую электронную теорию химической связи предложил в 1916 г. американский химик Гилберт Ньютон Льюис (1875—1946). Как уже было известно, завершённые электронные оболочки атомов благородных газов отличаются особенной устойчивостью. Льюис предположил, что при образовании химической связи возникают пары электронов, которые принадлежат сразу двум атомам. Тем самым атомы заполняют до конца свой внешний электронный уровень и приобретают электронную конфигурацию благородного газа. Льюис назвал это правилам октета, так как атомы всех благородных газов (кроме гелия) имеют на внешнем уровне восемь электронов. С помощью правила октета удалось объяснить электронное строение огромного числа соединений. А связь, образованная за счёт общей пары электронов, получила название ковалентной.
Для обозначения электронов Льюис использовал точки: Н:Н. Но часто общую пару электронов изображают просто чёрточкой, которая и символизирует химическую связь: Н—Н. В молекуле Н2 каждому атому принадлежат два электрона (конфигурация атома гелия), которые предоставлены в общее пользование двумя атомами водорода (это обменный механизм образования ковалентной связи).
Подобным образом устроена и молекула F2. У атома фтора на внешнем уровне семь электронов — чтобы достичь электронной конфигурации неона не хватает одного. Поэтому каждый атом F отдаёт по одному электрону в общее пользование:
Теперь оба атома имеют на внешнем уровне по восемь электронов (октет), из которых два общих, а шесть (три пары) сохраняются в индивидуальном пользовании.

Фридрих Август Кекуле.
Основные понятия химии — «атом» и «молекула». Атомов известно лишь немногим более 100 видов, а вот молекул — свыше 18 млн. Столь богатое разнообразие обусловлено тем, что атомы разных элементов, взаимодействуя друг с другом, способны объединяться в молекулы, причём молекулы могут содержать разное число атомов одного вида. К этому выводу учёные пришли ещё в первой половине XIX в. Шотландский химик Арчибальд Купер (1831 — 1892) и немецкий химик Фридрих Август Кекуле (1829—1896) практически одновременно, в 1858 г., предложили изображать связи между атомами в виде чёрточек. Так появились структурные формулы молекул, показывающие, в каком порядке разные атомы связаны друг с другом.
Постоянная Авогадро настолько велика, что с трудом поддаётся воображению. Преподаватели и популяризаторы химии придумали десятки эффектных способов показать грандиозность этого числа. Вот некоторые из них.
В пустыне Сахара содержится менее трёх молей самых мелких песчинок.
Если футбольный мяч увеличить в NA раз по объёму, то в нём поместится земной шар. Если же в NA раз увеличить диаметр мяча, то в нём поместится самая большая галактика, включающая сотни миллиардов звёзд. Кстати, во Вселенной содержится примерно NA звёзд.
Если взять моль красителя (приблизительно стакан), пометить каким-либо способом все его молекулы, вылить в море и подождать, пока он равномерно распределится по всем морям и океанам до самого дна, то, зачерпнув в любом месте земного шара стакан воды, обязательно обнаружим в нём не один десяток «меченых» молекул.
При каждом вдохе человека в его лёгкие попадает несколько молекул кислорода и азота, которые находились в последнем выдохе Юлия Цезаря.
Если взять моль долларовых бумажек, они покроют все материки Земли двухкилометровым плотным слоем.
А этот пример создан по мотивам древней восточной легенды. В сказочном царстве находится огромная гранитная скала в виде куба с ребром, равным 1 км. Раз в столетие на скалу садится ворон и чистит о неё клюв, при этом скала стирается на 0,0001 г. Так вот, число лет, когда от скалы не останется ни одной песчинки, меньше, чем постоянная Авогадро.

Постоянную Авогадро определяли множеством косвенных методов. Например, из голубого цвета неба следует, что солнечный свет рассеивается в воздухе. Если бы этого не происходило, мы видели бы Солнце на совершенно чёрном небе. Дж. У. Рэлей показал: интенсивность рассеяния света зависит от числа молекул воздуха в единице объёма (так же как рассеяние солнечного луча в тёмной комнате зависит от «концентрации» пыли в воздухе) и не зависит от размера молекул, если они малы по сравнению с длиной волны света. А значит, измерив соотношение интенсивностей прямого солнечного света и рассеянного голубым небом, можно определить постоянную Авогадро. Для измерений нужны были учёные-альпинисты, так как наблюдения следовало проводить высоко в горах, где нет помех от пыли и водяных капель. Впервые подобные измерения выполнил итальянский математик и видный политический деятель Квинтино Селла (1827— 1884) на вершине горы Монте-Роза (4634 м), что на самом юге Швейцарии. Расчёты, сделанные на основании этих и более новых измерений английским физиком Уильямом Томсоном (лордом Кельвином, 1824—1907), показали, что моль содержит не менее 3•1023 и не более 15•1023 молекул. Измерения (на той же горе) повторил в 1910 г. французский физик Леон Бриллюэн; он получил для постоянной Авогадро значение 6,0•1023, очень близкое к современному.
Другой метод использовал французский учёный Жан Батист Перрен (1870—1942). Он под микроскопом подсчитывал число крошечных, диаметром около микрометра (1 мкм=10-6 м), шариков краски гуммигута, взвешенных в воде. Перрен решил, что к ним применимы те же законы, которым подчиняются молекулы газов. В таком случае можно определить «молярную массу» шариков; зная же массу шарика (её, в отличие от массы настоящих молекул, можно измерить), легко рассчитать постоянную Авогадро, разделив первое значение на второе. У Перрена получилось примерно 6,8•1023.
Появление второй статьи Лошмидта окружено некой тайной, которая, вероятно, никогда не будет разгадана. Дело в том, что в первой большой статье (почти 20 страниц) Лошмидт вывел формулу, позволяющую рассчитать значение NL. Однако сам он этот расчёт почему-то не сделал. Если в приведённую формулу подставить известные экспериментальные данные, получится, что NL=1,83•1018 — в 15 раз меньше современного значения (2,687•1019). Во второй статье впервые в научной литературе приводится значение постоянной Лошмидта: «866 биллионов/мм3», т. е. 8,66•1017 молекул/см3. Удивительно, что вторая статья (меньше двух страничек), хотя и подписана именем Лошмидта, по стилю сильно отличается от других его работ. Более того, приведённое в ней значение NL, как говорится, «взято с потолка», а в тексте много ошибок и опечаток...
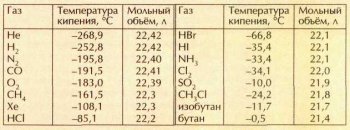
В справочниках можно прочитать, что моль газа при нормальных условиях занимает объём 22,41108 л. Но это справедливо лишь в отношении так называемого идеального газа, для которого принимается, что между молекулами не действуют силы притяжения или отталкивания, а объём самих молекул пренебрежимо мал. Очевидно, что такого газа в природе нет, а реальные газы в большей или меньшей степени отклоняются от законов, писанных для идеального. Между их молекулами всегда существуют силы притяжения, поэтому объём реального газа отличается от объёма идеального. Насколько — зависит от конкретного газа. Вот каковы округлённые мольные объёмы (при нормальных условиях) некоторых газов, рассчитанные из их плотностей:
Тенденция очевидна — чем ближе температура кипения газа к 0 °С, тем сильнее он отличается от идеального. Уравнение для расчёта состояния реальных газов предложил в 1873 г. нидерландский физик Йоханнес Дидерик Ван-дер-Ваальс (1837—1923). В отличие от уравнения идеального газа pV = nRT, в уравнение Ван-дер-Ваальса (р+n2a/V2)(V-nb)=nRT вводятся поправки, которые определяются экспериментом. Первая поправка n2alV учитывает взаимодействие между молекулами реального газа (оно тем меньше, чем больше объём, т. е. чем ниже давление); вторая поправка nb учитывает собственный объём молекул газа.
Поправки становятся существенными при высоких давлениях газов. Так, для азота при давлении порядка 80 атм. расчёт по уравнению идеального и реального газа отличается примерно на 5 %, а с увеличением давления в 5 раз разница достигает уже 100%!
В 30-х гг. XIX в. французский химик Жан Батист Дюма (1800— 1884) исследовал реакцию замещения водорода хлором в органических соединениях. В частности, при хлорировании уксусной кислоты СН3СООН учёный получил трихлоруксусную кислоту CCl3COOH. Однако многие химики отнеслись к работе Дюма с недоверием. Ведь согласно общепринятой тогда теории Берцелиуса, положительно заряженные атомы водорода не могли заместиться отрицательно заряженными атомами хлора.
Это обстоятельство решил обыграть известный немецкий химик Фридрих Вёлер. В 1840 г. он передал своему другу, не менее известному учёному и издателю «Анналов химии» Юстусу Либиху статью от имени некоего Ш. Виндлера (Schwindler по-немецки — «мошенник») о новом удачном приложении открытой Дюма реакции. В статье с явной издёвкой говорилось о том, как в уксуснокислом марганце Мn(СН3СОО)2 (его тогда изображали так: МnО•С4Н6О3) удалось все элементы заместить на хлор и в результате получить жёлтое кристаллическое вещество, состоящее из одного только хлора: Cl2Cl2•Cl8Cl6Cl6. Далее сообщалось, будто в Англии, последовательно замещая в органических соединениях все атомы на атомы хлора, обычные ткани превращают в хлорные и при этом веши сохраняют свой внешний вид. В примечании было указано, что лондонские лавки бойко торгуют материалом, состоящим из одного хлора, поскольку такая ткань очень хороша для ночных колпаков и тёплых подштанников.
Либиху шутка понравилась, и он опубликовал сочинение Ш. Виндлера (на французском языке) всего через несколько страниц после статьи Дюма. Намёк получился очень прозрачным. Тем не менее прав оказался всё же Дюма.
Свойства газов в конце XVIII — начале XIX в. исследовали многие учёные. Так, зависимость между обьёмом газа и температурой (при постоянном давлении) ещё до Гей-Люссака изучал французский физик Жак Александр Сезар Шарль (1746—1823). Однако он вовремя не опубликовал полученные данные, Гей-Люссак же чётко сформулировал закон, который у нас называют законом Гей-Люссака, а, например, в Англии и США — законом Шарля. С зависимостью давления газа от абсолютной температуры (при постоянном объёме) всё наоборот: в нашей стране он известен как закон Шарля, а в Англии и США — как закон Гей-Люссака. Иногда эти законы называют соответственно первым и вторым законами Гей-Люссака.
Любопытно, что оба учёных прославились также своими полётами на воздушных шарах. В декабре 1783 г. Шарль вместе с коллегой Франсуа Робером в присутствии 400 тыс. зрителей предпринял первый полёт на воздушном шаре, заполненном водородом. Гей-Люссак, тоже на пару с физиком Жаном Батистом Био, поставил в 1804 г. рекорд высоты, поднявшись на 7000 м.
Французский учёный Жозеф Луи Гей-Люссак (1778—1850) прославился и как физик, и как химик. Его имя носят газовые законы, которые сыграли большую роль в разработке атомно-молекулярного учения. В 1802 г. Гей-Люссак установил, что объём газа при постоянном давлении увеличивается пропорционально температуре.
Несколько позже он сформулировал ещё один закон: давление газа в замкнутом объёме также пропорционально температуре.
В 1808 г. Гей-Люссак (совместно с немецким естествоиспытателем Александром Гумбольдтом) сформулировал важнейший для развития химии закон объёмных отношений. Согласно ему, реагирующие газы соединяются таким образом, что соотношение между их объёмами, а также объёмом газообразного продукта реакции выражается простыми целыми числами (при условии, что температура и давление остаются постоянными). Например, 2 объёма водорода соединяются с 1 объёмом кислорода, давая 2 объёма водяного пара; 1 объём хлора реагирует с 1 объёмом водорода, что даёт 2 объёма нового газа — хлороводорода; 3 объёма водорода и 1 объём азота образуют 2 объёма аммиака, и т. д. Сейчас мы записали бы стехиометрические уравнения реакций просто и лаконично: 2Н2+О2=2Н2О; Сl2+Н2=2НСl; ЗН2+N2=2NH3. Но в те времена ещё не было чёткого разграничения понятий атома и молекулы, не существовало и современных обозначений химических элементов, формул их соединений.