Газы не имеют собственной формы и объёма и, как правило, смешиваются друг с другом в любых соотношениях (если, конечно, между ними не идёт химическая реакция). Эти свойства газов обусловлены тем, что молекулы в них находятся далеко друг от друга. Доля свободного объёма, т. е. пространства, не занятого самими молекулами, в газах при нормальных условиях (атмосферном давлении и температуре 0 °С) составляет более 99%. В этом объёме молекулы газов хаотически движутся с большой скоростью, постоянно сталкиваясь друг с другом. Собственно, само слово «газ» происходит от греческого «хаос»; этот термин ввёл в XVII в. нидерландский естествоиспытатель Ян Баптист ван Гельмонт (1579—1644).
При небольших давлениях межмолекулярными взаимодействиями в газах можно пренебречь, т. с. разные газы ведут себя практически одинаково (если говорить о физических, а не химических свойствах). Такое состояние газа называется идеальным и описывается уравнением, связывающим его давление р, объём V, число молей n и температуру Т: pV = nRT, где R — универсальная газовая постоянная (R = 8,31 Дж/(моль•К)=0,082 (л•атм)/(моль • К)).
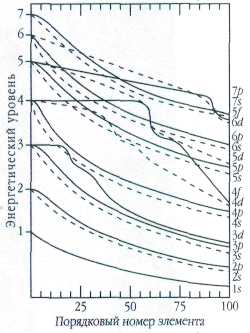
Изменение энергии орбиталей в зависимости от порядкового номера элемента.
При переходе от твёрдого состояния вещества к газообразному взаимодействие между частицами ослабевает.
Особенно сильно межмолекулярные взаимодействия проявляются при высоких давлениях и низких температурах, когда молекулы газа находятся близко друг к другу. В этом случае для описания свойств реального газа необходимо учитывать собственный объём молекул, а также силы притяжения между ними (см. статью «Волшебное число химиков»),

Похожие статьи