Принцип Ле Шателье прекрасно действует и в том случае, если в его формулировке опустить указание, что равновесная система должна быть химической. Множество примеров «сопротивления внешним воздействиям» можно найти и в жизни. Вот простая и всем знакомая ситуация. В нормально действующей экономике должно существовать равновесие между общей суммой находящихся в обращении денег и теми товарами, которые можно на эти деньги купить. Что будет, если «внешним воздействием» окажется желание правительства напечатать денег побольше, скажем, чтобы рассчитаться с долгами? В строгом соответствии с принципом Ле Шателье, равновесие между товаром и деньгами будет смешаться таким образом, чтобы ослабить удовольствие граждан от обладания большим количеством денег. А именно, цены на товары и услуги вырастут, и тем самым будет достигнуто новое равновесие.
К концу XIX в. дружными усилиями физиков и химиков была разработана важнейшая глава физической химии — учение о равновесиях химических реакций, или химическая термодинамика. Одновременно с учением о равновесиях создавалась теория о скоростях химических процессов — химическая кинетика. Накопленные ко второй половине XIX в. многочисленные экспериментальные данные и сформулированные на их основе закономерности (закон действующих масс, уравнение Аррениуса) считались твёрдо установленными. Тем не менее время от времени появлялись факты, которые невозможно было объяснить ни одной из существовавших теорий. Едва ли не самой загадочной оказалась очень простая с виду реакция водорода с хлором: Н2+Сl2=2НСl, которая может идти при нагревании либо при облучении светом. В последнем случае реакцию называют фотохимической (от греч. «фотос» — «свет»).
Механизм цепного процесса подобен эффекту домино. Зарождение, рост и обрыв цепи.
Константы равновесия определены для очень многих реакций. В большинстве случаев известно и то, как изменяется величина Кравн в зависимости от температуры. Располагая значением константы равновесия при данной температуре и зная, сколько каких веществ имеется в начальный момент, можно рассчитать концентрации всех компонентов равновесной смеси. В качестве примера рассмотрим реакцию диссоциации в растворе уксусной кислоты: СН3СООН «СН3СОО-+Н+. Пусть с0 — исходная концентрация кислоты. Очевидно, что при равновесии (здесь оно достигается исключительно быстро) [СН3СООН]равн=с0-[Н+]равн и [СН3СОО]равн=[Н+]. Тогда для константы равновесия можно записать уравнение
Кравн = [СН3СОО-]равн[Н+]равн/(с0 - [H+]равн) = [Н+]2равн/(с0 - [H+]равн).
Анри Луи Ле Шателье
(1850—1936)

В 1884 г. французский физикохимик и металловед Анри Луи Ле Шателье сформулировал общий принцип смещения химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Доказать протекание прямой и обратной реакций после достижения равновесия можно множеством способов. Так, если в равновесную смесь водорода, азота и аммиака ввести немного изотопа водорода — дейтерия, то чувствительный анализ сразу обнаружит присутствие дейтерия в молекулах аммиака. И наоборот, если ввести в систему немного дейтерированного аммиака NH2D, дейтерий тут же появится в молекулах исходного вещества в виде HD и D2.
Если смешать растворы кислоты и щёлочи, образуются соль и вода, например:
НСl+NaOH=NaCl+H2O. Если же попытаться провести реакцию хлорида натрия с водой, то никаких изменений не обнаружится. В подобных случаях говорят, что реакция кислоты со щёлочью необратима, т. е. обратный процесс не идёт, во всяком случае, при комнатной температуре в водном растворе. (Последняя оговорка необходима, так как, действуя на хлорид натрия перегретым водяным паром при 500 °С и давлении 10 атм, можно провести обратную реакцию — гидролиз NaCl, при которой пар будет уносить летучий хлороводород, оставляя твёрдую щёлочь:
NaCl+Н2О®t°NaOH+HCl.) Практически необратимы при комнатной температуре очень многие реакции:
Н2+Сl2=2НСl; 2Н2+О2=2Н2О и др. Для обозначения обратимых процессов договорились использовать символ ««» вместо знака равенства.
Большое число реакций обратимы уже в обычных условиях. Так, если попытаться нейтрализовать щёлочью раствор очень слабой синильной кислоты HCN, окажется, что реакция нейтрализации, как говорят химики, до конца не идёт, и раствор имеет сильнощелочную среду. Это означает, что реакция HCN + NaOH«NaCN+Н2О обратима, т. е. её продукты, взаимодействуя друг с другом, частично переходят в исходные соединения.
Химия не только изучает окружающий мир, но и активно видоизменяет его, создавая новые материалы, процессы и реакции. В этом смысле современная химическая кинетика пока делает только самые первые шаги. После того как были достигнуты определённые успехи в экспериментальном и теоретическом изучении элементарных реакций, исследователи задались вопросом: как можно управлять химической реакцией, т. е. в идеале проводить её по заранее запланированному пути и с заданной скоростью?
Для решения этой задачи надо знать различные пути реакции, т. е. иметь в своём распоряжении всю информацию о многомерной поверхности потенциальной энергии. Подобные расчёты довольно сложны даже для таких реакций, в которых участвует всего несколько атомов.
С другой стороны, химики научились произвольно изменять направление некоторых реакций. Так, используя определённую последовательность лазерных импульсов, удалось осуществить полностью контролируемую диссоциацию молекулы полутяжёлой воды HOD по любому из двух направлений:
Некоторые реакции проявляют аномальные температурные эффекты. Например, скорость биохимических реакций, катализируемых ферментами, зависит от температуры следующим образом. Вплоть до некоторой критической температуры скорость ферментативной реакции увеличивается в соответствии с уравнением Аррениуса, а затем происходит денатурация фермента (нарушение его природной конфигурации), он теряет каталитические свойства, и скорость реакции уменьшается. Это приводит, в частности, к тому, что у больных людей при высокой температуре биохимические процессы в организме протекают не так, как при нормальной.
В школьных учебниках зависимость скорости реакции от температуры описывается правилом Вант-Гоффа. Однако в подавляющем большинстве изданий по физической химии это правило даже не упоминается или же отмечается, что оно носит весьма приближённый характер и представляет чисто исторический интерес.
Дело в том, что для очень многих реакций правило Вант-Гоффа не выполняется. Так, для реакции атомов водорода с этаном Н+С2Н6=Н2+С2Н5 энергия активации Е=40,6 кДж/моль. Расчёт по формуле Аррениуса даёт ускорение в 1,69 раза при повышении температуры от 300 до 310 К (27— 37 °С) и только в 1,04 раза при повышении температуры от 1090 до 1100 К (817—827 °С), так что при высоких температурах скорость этой реакции от температуры практически не зависит. Для реакции присоединения атомов водорода к этилену Н+С2Н4=С2Н5 с низкой энергией активации (£ = 3,4 кДж/моль) скорость увеличится только в 1,8 раза при повышении температуры от 453 до 463 К (180—190 °С). Если же рассмотреть реакцию С2Н6+С2Н4=2С2Н5 с высокой энергией активации (Е=251 кДж/моль), то для неё точно такое же повышение температуры (от 180 до 190 °С) вызовет увеличение скорости уже в 4,6 раза.
Большинство химических и биохимических процессов с ростом температуры заметно ускоряются. Так, мясо при комнатной температуре испортится гораздо скорее, чем в холодильнике. В странах с влажным тропическим климатом фрукты созревают раньше, а машины ржавеют быстрее,
чем в северных широтах. Железо не реагирует с холодной концентрированной серной кислотой, но растворяется в горячей.
Этот эффект ещё в XIX в. был описан с помощью эмпирического (т. е. выведенного из опытных данных) правила Вант-Гоффа:
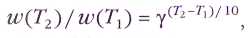
Даже по самому простому уравнению реакции нельзя сказать, является ли она элементарной или нет. Реакцию иода с водородом Н2+I2=2HI долгое время считали элементарной, потому что её скорость описывалась уравнением w = k[H2][I2], характерным для бимолекулярных реакций. Но потом выяснилось, что реакция эта сложная и состоит по меньшей мере из трёх элементарных. На первой стадии молекула иода при нагревании распадается на атомы: 12®k12I. Атомы могут либо опять превратиться в молекулу иода: 2I®k2I2, либо столкнуться с молекулой водорода и образовать две молекулы иодоводорода: 2I+Н2®k3HI