Большинство химических и биохимических процессов с ростом температуры заметно ускоряются. Так, мясо при комнатной температуре испортится гораздо скорее, чем в холодильнике. В странах с влажным тропическим климатом фрукты созревают раньше, а машины ржавеют быстрее,
чем в северных широтах. Железо не реагирует с холодной концентрированной серной кислотой, но растворяется в горячей.
Этот эффект ещё в XIX в. был описан с помощью эмпирического (т. е. выведенного из опытных данных) правила Вант-Гоффа:
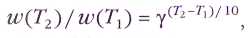
Скорость многих реакций при нагревании на 10 °С увеличивается в 2—4 раза.
Так, при повышении температуры с 30 до 40 °С скорость гидролиза сахарозы в присутствии кислоты возрастает в 3,9 раза.
Математически правило Вант-Гоффа можно записать в виде степенной зависимости:
Скорость реакции сильно зависит от температуры. В холодном климате химические реакции, обусловливающие созревание яблок, протекают гораздо медленнее, чем в жарком.
Взаимодействие сурьмы с бромом:
1 — при комнатной температуре;
2 — при нагревании.
где g — температурный коэффициент, который показывает, во сколько раз увеличивается скорость реакции при нагревании на 10 °С (или, что одно и то же, на 10 К).
Однако правило Вант-Гоффа справедливо лишь при небольшом изменении температуры и далеко не для всех реакций. Гораздо более точно описывает температурные эффекты в химической кинетике уравнение Аррениуса для константы скорости:
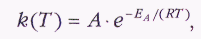
где А и ЕА — постоянные величины, которые не зависят от температуры, а определяются только природой реагирующих веществ; R — универсальная газовая постоянная. Температура T в уравнении Аррениуса измеряется по шкале Кельвина. Последний сомножитель равен доле активных молекул, энергия которых больше некоторого порогового значения ЕА. Величину ЕА называют энергией активации. Доля молекул, имеющих энергию большую чем ЕА, быстро растёт с увеличением температуры. Энергию активации реакции можно определить экспериментальным путём, если измерить зависимость константы скорости (или самой скорости) от температуры.

Похожие статьи