Если смешать растворы кислоты и щёлочи, образуются соль и вода, например:
НСl+NaOH=NaCl+H2O. Если же попытаться провести реакцию хлорида натрия с водой, то никаких изменений не обнаружится. В подобных случаях говорят, что реакция кислоты со щёлочью необратима, т. е. обратный процесс не идёт, во всяком случае, при комнатной температуре в водном растворе. (Последняя оговорка необходима, так как, действуя на хлорид натрия перегретым водяным паром при 500 °С и давлении 10 атм, можно провести обратную реакцию — гидролиз NaCl, при которой пар будет уносить летучий хлороводород, оставляя твёрдую щёлочь:
NaCl+Н2О®t°NaOH+HCl.) Практически необратимы при комнатной температуре очень многие реакции:
Н2+Сl2=2НСl; 2Н2+О2=2Н2О и др. Для обозначения обратимых процессов договорились использовать символ ««» вместо знака равенства.
Большое число реакций обратимы уже в обычных условиях. Так, если попытаться нейтрализовать щёлочью раствор очень слабой синильной кислоты HCN, окажется, что реакция нейтрализации, как говорят химики, до конца не идёт, и раствор имеет сильнощелочную среду. Это означает, что реакция HCN + NaOH«NaCN+Н2О обратима, т. е. её продукты, взаимодействуя друг с другом, частично переходят в исходные соединения.
В конце XIX в. немецкий химик Макс Боденштейн (1871 — 1942) детально изучил процессы образования и термической диссоциации иодоводорода: Н2+I2 «2HI. Изменяя температуру, он мог добиться преимущественного протекания только прямой или только обратной реакции, но в общем случае обе реакции шли одновременно в противоположных направлениях. Подобных примеров множество. Один из самых известных — реакция синтеза аммиака: ЗН2+N2«2NH3. Многие реакции между органическими веществами также не идут до конца.
Яркий пример динамического равновесия — природный водоём. Хотя из озера Байкал вытекает река Ангара и вода с его поверхности постоянно испаряется, уровень воды в озере не понижается многие десятки лет — озеро подпитывается атмосферными осадками, реками и водами подземных источников.
Как узнать: обратима данная реакция (при определённых условиях) или нет? Подобно многим другим понятиям в химии, понятие обратимости достаточно условно. Обычно необратимым считают химический процесс, после завершения которого концентрации исходных веществ настолько малы, что их не удаётся обнаружить (конечно, это зависит от чувствительности методов анализа). При изменении внешних условий, прежде всего температуры и давления, необратимая реакция может стать обратимой, и наоборот.
Рассмотрим в общем виде обратимую реакцию А+В«С+D. Если предположить, что прямая и обратная реакции проходят в одну стадию, то скорости этих реакций будут прямо пропорциональны концентрациям реагентов: скорость прямой реакции w1 = k1[А][В], скорость обратной реакции w2=k2[C][D] (см. статью «Время в химии: скорость химических реакций»). Очевидно, что по мере протекания прямой реакции концентрации исходных веществ А и В снижаются, соответственно, уменьшается и скорость прямой реакции. Скорость же обратной реакции, которая в начальный момент времени равна нулю (продукты С и D ещё не образовались), постепенно увеличивается. Рано или поздно наступит момент, когда скорости обеих реакций сравняются. После этого концентрации всех веществ — А, В, С и D — не будут изменяться со временем (такие концентрации называются равновесными). Это значит, что реакция достигла положения равновесия. Но в отличие от механического равновесия, при котором всякое движение прекращается, при химическом равновесии обе реакции — и прямая, и обратная — продолжают идти. Просто скорости их равны, и потому кажется, что никаких изменений в системе не происходит.
Важнейший параметр, характеризующий обратимую химическую реакцию, — константа равновесия Кравн. Запишем для реакции А+В«C+D (предполагается, что она элементарная) условие равенства скоростей прямой и обратной реакций в состоянии равновесия:
Итак, при равновесии отношение произведения концентраций продуктов реакции к произведению концентраций реагентов постоянно, если постоянна температура (поскольку константы скорости k1 и k2 и, следовательно, константа равновесия Кравн зависят от температуры).
Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия (но не констант скорости!) возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так, для реакции ЗН2+N2«2NH3 выражение для константы равновесия записывается в виде
Kpaвн=[NH3]2paвн/[H2]3paвн[N2]paвн.
Константы равновесия часто считают размерными величинами. Размерность константы зависит от конкретной реакции. Например, для реакции 3Н2+N2«2NH3 размерность константы
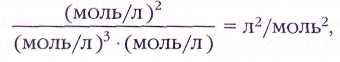
а вот для реакции Н2+I2«2HI константа равновесия не имеет размерности.
Если реагенты — газообразные соединения, то вместо концентраций для записи константы равновесия обычно используют давления; очевидно, что численное значение константы при этом другое. Следует отметить, что приведённый здесь метод вывода константы равновесия, основанный на скоростях прямой и обратной реакций, применим только в случаях самых простых процессов, так как для сложных зависимость скорости от концентрации может быть неизвестна.
Большая величина Кравн означает, что числитель намного превышает знаменатель, т. е. продуктов значительно больше, чем исходных веществ. В этом случае химики говорят, что равновесие реакции сдвинуто вправо. Соответственно, при малых значениях К равн прямая реакция протекает в незначительной степени — равновесие сдвинуто влево. Введение катализатора не сдвигает положение равновесия, а только ускоряет его достижение (поскольку катализатор в равной мере ускоряет и прямую, и обратную реакцию). Графики, показывающие, как система приближается к равновесию, называются кинетическими кривыми.
Чтобы предсказать возможность протекания реакции aА+bB«сС+dD в данном направлении, необходимо определить знак изменения свободной энергии Гиббса DG (см. статью «Быть или не быть реакции? Химическая термодинамика»). В курсе физической химии выводится уравнение, связывающее DG со стандартным значением изменения энергии Гиббса (АС) и концентрациями всех реагентов:
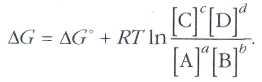
Если DG<0, реакция пойдёт слева направо, если DG>0 — справа налево, а при достижении равновесия DG=0. В последнем случае формулу можно переписать в виде DG0=-RTlnKравн. Это позволяет без проведения многочисленных и сложных экспериментов вычислять значения Кравн для разнообразных химических реакций и, соответственно, рассчитывать равновесные концентрации исходных веществ и продуктов.
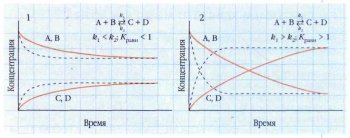
Кинетические кривые:
1 — если k1<k2,
то К равн<1, равновесие сдвинуто в сторону исходных веществ;
2 — если k1>k2,
то К равн>1, равновесие сдвинуто в сторону продуктов реакции. Пунктиром показано приближение к равновесию в присутствии катализатора.
В редком случае, когда k1=k2
Kравн=1), кинетические кривые для исходных веществ и продуктов сольются.
Возможность подобных расчётов стала важнейшим успехом химической термодинамики.

Между осадком вещества и его насыщенным раствором существует химическое равновесие: часть вещества из осадка непрерывно переходит в раствор, а из раствора — в осадок. Количество осаждённого вещества и концентрация раствора при этом не меняются.

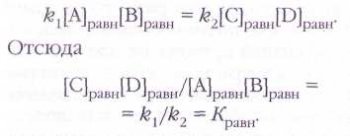
Похожие статьи