В школьных учебниках зависимость скорости реакции от температуры описывается правилом Вант-Гоффа. Однако в подавляющем большинстве изданий по физической химии это правило даже не упоминается или же отмечается, что оно носит весьма приближённый характер и представляет чисто исторический интерес.
Дело в том, что для очень многих реакций правило Вант-Гоффа не выполняется. Так, для реакции атомов водорода с этаном Н+С2Н6=Н2+С2Н5 энергия активации Е=40,6 кДж/моль. Расчёт по формуле Аррениуса даёт ускорение в 1,69 раза при повышении температуры от 300 до 310 К (27— 37 °С) и только в 1,04 раза при повышении температуры от 1090 до 1100 К (817—827 °С), так что при высоких температурах скорость этой реакции от температуры практически не зависит. Для реакции присоединения атомов водорода к этилену Н+С2Н4=С2Н5 с низкой энергией активации (£ = 3,4 кДж/моль) скорость увеличится только в 1,8 раза при повышении температуры от 453 до 463 К (180—190 °С). Если же рассмотреть реакцию С2Н6+С2Н4=2С2Н5 с высокой энергией активации (Е=251 кДж/моль), то для неё точно такое же повышение температуры (от 180 до 190 °С) вызовет увеличение скорости уже в 4,6 раза.
Эти простые расчёты находятся в явном противоречии с правилом Вант-Гоффа. Возникает вопрос: откуда же это правило взялось, если оно неверно, и для чего оно вообще нужно? Ответ неожиданный: правило на самом деле почти всегда справедливо, если реакцию изучают... в школьном химическом кружке. Ведь с помощью простого оборудования, имеющегося в кабинете химии, можно изучать скорости далеко не всех реакций, а только таких, которые идут не слишком быстро и не очень медленно.
Действительно, если реакция заканчивается, положим, за одну-две секунды, за ней просто невозможно уследить «невооружённым глазом». Если же она протекает месяцами, а порой и годами, то чувствительности школьного оборудования не хватит, чтобы заметить изменение со временем концентрации реагентов. А вот когда реакция завершается за один-два часа, её удобно измерять, например, методом отбора проб. Из реакционной смеси периодически, допустим через каждые пять или десять минут, отбирают с помощью пипетки или шприца небольшую пробу и определяют в ней концентрацию исходных веществ или продуктов реакции.
Именно так и работали химики во времена Вант-Гоффа. И изучали они кинетику только таких реакций, которые идут с удобной для измерения скоростью. Если реакция имела небольшую энергию активации и шла слишком быстро, для её замедления температуру понижали. Если же, наоборот, надо было изучить скорость реакции с высокой энергией активации, температуру повышали, чтобы реакцию ускорить до «удобного» значения. В обоих случаях как бы сами собой получались определённые соотношения между энергией активации и температурой — такие, при которых выполняется правило Вант-Гоффа.
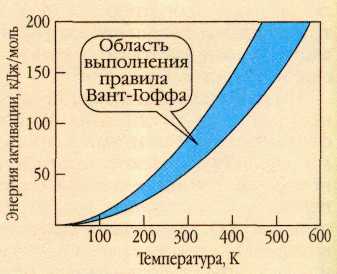
Соотношение между энергией активации и температурой, при котором выполняется правило Вант-Гоффа.
Эти соотношения наглядно представлены на графике: значения энергии активации и температуры, соответствующие правилу Вант-Гоффа, располагаются между двумя ветвями параболы. Если для какой-либо реакции они окажутся под нижней ветвью, такая реакция будет ускоряться меньше чем в 2 раза при повышении температуры на 10 °С, а если над верхней — реакция ускорится более чем в 3 раза.
В настоящее время экспериментальная техника позволяет изучать как исключительно быстрые, так и очень медленные химические реакции, для которых температурный коэффициент может быть и намного меньше 2, и значительно больше 3. Поэтому правило Вант-Гоффа современным химикам не нужно.
Похожие статьи