Анри Луи Ле Шателье
(1850—1936)

В 1884 г. французский физикохимик и металловед Анри Луи Ле Шателье сформулировал общий принцип смещения химического равновесия:
Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменять температуру, давление, концентрации веществ), то положение равновесия смещается в такую сторону, чтобы ослабить внешнее воздействие.
Система как бы стремится противостоять изменению внешних условий. Когда, например, температуру равновесной смеси повышают, сама система, конечно, не может ослабить внешний нагрев. Однако равновесие в системе смещается таким образом, что для нагревания её до определённой температуры требуется уже большее количество теплоты. А именно: сдвиг равновесия идёт в сторону эндотермической реакции (протекающей с поглощением теплоты).
Если в левой и правой частях уравнения имеется неодинаковое число молекул газообразных веществ, то равновесие в такой системе можно сместить и путём изменения давления. (Это происходит даже система «противодействует» внешнему давлению); при понижении давления равновесие
смещается в обратную сторону. Когда число молекул газов в ходе реакции не меняется, давление не будет влиять на положение равновесия. В качестве примера можно привести реакции Н2+Вr2(г) «2НВr; СО+Н2О(г) «СО2+Н2 и др. Для рассмотренной ранее реакции синтеза аммиака повышение давления смещает равновесие в сторону меньшего числа молекул, т. е. в сторону NН3.
Пример противоположного влияния температуры и давления на положение равновесия — промышленная реакция дегидрирования (отщепления водорода) циклогексана с образованием бензола: С6Н12 «С6Н6+3Н2. Её проводят в газовой фазе в присутствии катализатора.
Реакция идёт с затратой энергии (т. е. она эндотермическая), но с увеличением числа молекул. Поэтому влияние температуры и давления на неё будет прямо противоположным тому, которое наблюдается в случае синтеза аммиака. То есть увеличению равновесной концентрации бензола в смеси способствует повышение температуры и понижение давления, Вот почему в промышленности реакцию проводят при невысоких давлениях (2—3 атм) и высоких температурах (450—500 °С). Здесь повышение температуры «дважды благоприятно»: оно не только ускоряет процесс, но и способствует сдвигу равновесия в сторону образования необходимого продукта.
Конечно, ещё большее снижение давления (например, до 0,1 атм) вызвало бы дальнейшее смещение равновесия вправо. Однако при этом в реакторе будет находиться слишком мало вещества, а значит, уменьшится и скорость реакции, так что общая производительность не повысится, а понизится.
Этот пример ещё раз показывает, что экономически обоснованный синтез — это удачное лавирование «между Сциллой и Харибдой».
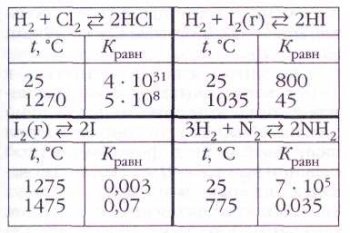
Ярким подтверждением принципа Ле Шателье являются многочисленные экспериментальные данные. Некоторые примеры указаны в приведённой таблице.
Видно, что для одних реакций (экзотермических) значение Кравн с ростом температуры уменьшается; для других (эндотермических) — увеличивается.
Похожие статьи