Химия — наука не только экспериментальная, но и теоретическая. Можно ли теоретически рассчитать скорость реакции и предсказать скорости новых, ещё неизвестных реакций?
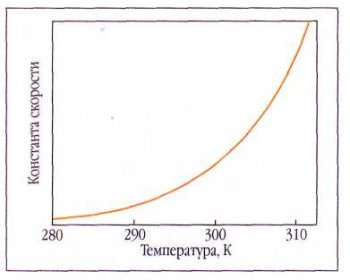
Константа скорости химической реакции быстро возрастает с повышением температуры.
Энергия частицы, участвующей в химической реакции, меняется подобно тому, как это происходит у шара для гольфа, катящегося по неровной поверхности игрового поля и попадающего в лунку. Своеобразной энергетической «лункой» для частицы является образование устойчивого продукта реакции.
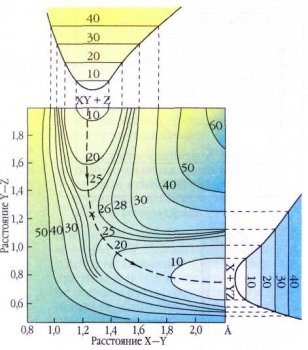
Контурная карта поверхности потенциальной энергии для реакции
X+YZ®XY+Z.
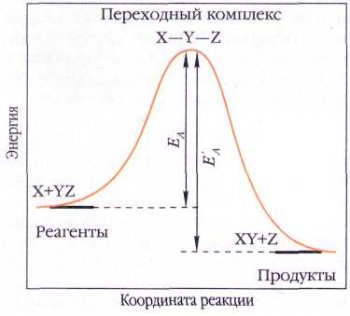
Энергетическая кривая, показывающая изменение энергии ядер в ходе химической реакции.
Ни один из химических процессов не протекает мгновенно. В любом случае между реагентами и продуктами существует некое промежуточное образование — так называемое переходное состояние, или переходный (активированный) комплекс, в котором некоторые связи ослаблены или усилены по сравнению с реагентами. Можно считать, что переходное состояние — это конфигурация атомов, соответствующая переходу от исходных веществ к продуктам в элементарной реакции. А можно выразиться ещё проще: переходное состояние — это уже не реагенты, но ещё не продукты.
В простейшей модели химической реакции атомные ядра представляют твёрдыми шариками, которые движутся по законам классической механики. Химики, изучая «шаг за шагом» сближение и взаимодействие молекул, могут изобразить на бумаге или воссоздать на экране компьютера некую особую поверхность, называемую поверхностью потенциальной энергии, которая отражает зависимость общей энергии взаимодействия всех ядер и электронов химической системы от всех межъядерных расстояний. Минимумы на поверхности соответствуют устойчивым состояниям реагентов и продуктов реакции, а область вблизи максимума (точки перевала) — переходному состоянию. Разность между максимумом и энергией исходных веществ — это энергия активации прямой реакции. Разность между максимумом и энергией продуктов — энергия активации обратной реакции. Разность между энергиями исходных веществ и продуктов равна тепловому эффекту реакции. Поверхности потенциальной энергии обычно многомерны, т. е. зависят от многих переменных, поэтому их трудно представить наглядно. Исключение — случай линейного столкновения атома и двухатомной молекулы: X+YZ®XY+Z, когда энергия зависит только от двух межъядерных расстояний: X—Y и Y—Z. Для такой реакции поверхность потенциальной энергии имеет достаточно простой вид. Дня химической кинетики важна не вся энергетическая поверхность, а лишь небольшой её участок вблизи наиболее вероятной траектории изменения энергии ядер. Эту траекторию называют координатой химической реакции.

Похожие статьи