Даже по самому простому уравнению реакции нельзя сказать, является ли она элементарной или нет. Реакцию иода с водородом Н2+I2=2HI долгое время считали элементарной, потому что её скорость описывалась уравнением w = k[H2][I2], характерным для бимолекулярных реакций. Но потом выяснилось, что реакция эта сложная и состоит по меньшей мере из трёх элементарных. На первой стадии молекула иода при нагревании распадается на атомы: 12®k12I. Атомы могут либо опять превратиться в молекулу иода: 2I®k2I2, либо столкнуться с молекулой водорода и образовать две молекулы иодоводорода: 2I+Н2®k3HI
Совокупность элементарных стадий, составляющих сложную реакцию, называют механизмом реакции. С учётом трёхстадийного механизма реакции иода с водородом её скорость определяется формулой
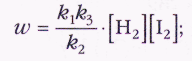
при этом общая константа скорости (её обычно называют экспериментальной или эффективной) выражается через константы скоростей элементарных стадий. Мы видим, что два разных механизма реакции —- одностадийный и трёхстадийный — дают одинаковую зависимость скорости от концентрации реагентов. И чтобы понять, какой же механизм работает в действительности, нужны дополнительные экспериментальные данные. Исследование механизмов химических реакций — основная задача химической кинетики (так называемая обратная задача). Для изучения механизма реакции прежде всего экспериментально определяют зависимость скорости этой реакции от концентраций реагентов, т. е. порядок реакции по каждому реагенту. Затем предлагают пробный механизм и для него теоретически находят зависимость скорости от концентрации (решают так называемую прямую задачу). Если теоретическая зависимость совпадает с экспериментальной, механизм, возможно, подобран правильно, если нет — предлагают другой.
Многие сложные реакции включают большое количество (до нескольких десятков) элементарных стадий, каждая из которых описывается своим кинетическим уравнением. В таких случаях зависимость скорости от концентрации может оказаться очень сложной. Ситуация упрощается, если какая-либо из этих стадий протекает намного медленнее остальных. Тогда вступает в силу один из важных принципов кинетики — принцип лимитирующей стадии: скорость сложной реакции определяется скоростью самой медленной (лимитирующей) элементарной стадии.
Его ещё называют принципом бутылочного горлышка, узкого места, тормоза и т. д. — по бытовым аналогиям лимитирующей стадии. Действительно, если вода выливается через систему отверстий, то скорость всего процесса будет определяться скоростью её прохождения через самое узкое отверстие. Средняя скорость автомобиля на оживлённой магистрали зависит от скорости движения через «пробки» — места, где скапливается много машин. Если взвод солдат бежит кросс, то результат взвода определяется скоростью бега самого медлительного бойца. Этот принцип часто позволяет выразить скорость сложной реакции через скорости одной или нескольких элементарных стадий.
В общем случае для сложных реакций тоже можно сформулировать закон действующих масс
Скорость сложной реакции пропорциональна произведению концентраций реагирующих молекул, возведённых в некоторые степени.
Например, для реакции А+®Рw=k[A]x[В]y. Показатели степени х и у, которые называют порядками по веществам А и В, в общем случае никак не связаны с коэффициентами в уравнении реакции. Эти числа могут быть положительными, отрицательными или дробными. Большое разнообразие порядков характерно для гетерогенных реакций. Так, реакция разложения стибина SbH3 на поверхности сурьмы имеет порядок 0,6, а реакция окисления СО кислородом на поверхности платины 2СО+О2=2СО2 — отрицательный (минус первый) порядок по СО: w=k[О2]/[СО], т. е. при увеличении концентрации СО скорость реакции уменьшается.
Необычный — дробный или отрицательный — порядок реакции однозначно указывает на её сложный механизм. Но иногда порядок сложной реакции может совпадать с коэффициентами в уравнении, как, например, для рассмотренной нами реакции иода с водородом.

Похожие статьи