Константы равновесия определены для очень многих реакций. В большинстве случаев известно и то, как изменяется величина Кравн в зависимости от температуры. Располагая значением константы равновесия при данной температуре и зная, сколько каких веществ имеется в начальный момент, можно рассчитать концентрации всех компонентов равновесной смеси. В качестве примера рассмотрим реакцию диссоциации в растворе уксусной кислоты: СН3СООН «СН3СОО-+Н+. Пусть с0 — исходная концентрация кислоты. Очевидно, что при равновесии (здесь оно достигается исключительно быстро) [СН3СООН]равн=с0-[Н+]равн и [СН3СОО]равн=[Н+]. Тогда для константы равновесия можно записать уравнение
Кравн = [СН3СОО-]равн[Н+]равн/(с0 - [H+]равн) = [Н+]2равн/(с0 - [H+]равн).
Решая это квадратное уравнение (и опуская для простоты обозначение «равн»), получаем два решения:
Выбираем первое, поскольку очевидно, что второе решение не имеет физического смысла: концентрация не может быть отрицательной величиной.
Уксусная кислота относится к слабым кислотам; при комнатной температуре для реакции её диссоциации Кравн=1,75•10-5, т. е. равновесие сдвинуто влево — в сторону недиссоциированных молекул. Поэтому выведенную формулу для расчёта концентрации ионов водорода можно заметно упростить. Действительно, для малых К концентрация молекул кислоты при диссоциации практически не уменьшается, так что с0=[Н+]. При этом выражение для константы равновесия
запишется в виде К = [Н+]2/с0, откуда
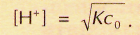
Например, если концентрация уксусной кислоты равна 1 моль/л,
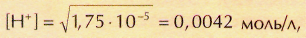
т. е. продиссоциировала очень малая часть молекул. С разбавлением кислоты разница между её концентрацией и концентрацией ионов водорода становится не такой большой. Так, при с0=0,01 моль/л
Формулы для константы равновесия сложных реакций оказываются значительно более громоздкими, причём из них не всегда можно вывести аналитические выражения для расчёта концентраций (например, если получается уравнение пятой степени). Тем не менее расчёт концентраций при использовании компьютерных программ не представляет каких-либо трудностей.
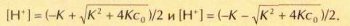
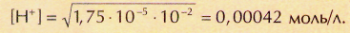
Похожие статьи