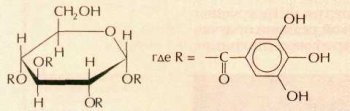В 1492 г. матросы Христофора Колумба, высадившись на острове, названном ими Сан-Сальвадор, увидели, что туземцы свёртывают трубочкой листья каких-то растений, поджигают их и втягивают в себя дым. Траву для курения местные жители называли «табаго», а трубочки — «сигаро». От этих названий и произошли современные слова «табак» и «сигара» («сигарета» — от исп. sigareta — «маленькая сигара»).
Сам Колумб так описал обычай курения листьев туземцами: «Высадившись на берег, мы отправились в глубь острова. Нас встретило множество почти голых людей, которые шли из своих деревень с горящими головешками в руках и травой, дым которой они „пили", т. е. глубоко вдыхали через рот в лёгкие. Некоторые несли одну большую „сигаро", при каждой остановке зажигали её, затем каждый делал из неё три-четыре затяжки, выпуская дым через ноздри».
Американские индейцы курили табак исключительно в ритуальных целях.
Углерод способен образовывать устойчивые кольца не только из собственных атомов; он охотно принимает в «циклическое содружество» и некоторые другие химические элементы — кислород, азот и серу. Органические соединения, в циклических молекулах которых кроме углерода имеются атомы других неметаллов, называют гетероциклическими (от греч. «гетерос» — «разный»). Гетероциклы содержатся в пуриновых и пиримидиновых основаниях, участвующих в построении информационных биомолекул РНК и ДНК, в некоторых аминокислотах, являющихся строительными блоками белков, в большинстве алкалоидов, многих антибиотиках, витаминах и растительных пигментах. Простого перечисления достаточно, чтобы понять, какую огромную роль в жизни растительных и животных организмов играют гетероциклические соединения.
Анилин (фениламин, C6H5NH2) — бесцветная ядовитая жидкость с характерным запахом, малорастворимая в воде (tкип = 184 °С). Так назвал это вещество Ю. Ф. Фрицше, выделивший его в 1840 г. из продуктов взаимодействия краски индиго со щёлочью (от араб. «ан-нил» — «синяя краска», «индиго»). Анилин — простейший представитель ароматических аминов. В соединениях этого класса свободная электронная пара атома азота аминогруппы «затянута» в бензольное ядро. Поэтому по свойствам анилин заметно отличается и от алифатических аминов, и от бензола. Так, по сравнению с аммиаком и алкиламинами (например, метиламином CH3NH2), анилин представляет собой гораздо более слабое основание. Его водные растворы не изменяют окраски лакмуса и фенолфталеина. Однако в присутствии сильных кислот анилин, как и другие амины, образует соли (например, хлорид фениламмония [C6H5NH3]+Cl-).
Одна из основных операций при выработке кожи и меха — дубление. Так принято называть обработку шкур специальными веществами, делающими поверхность материала более прочной и упругой.
Кожа состоит из тонких волокон белка коллагена, образующих своеобразную сетчатую структуру. Эта структура и придаёт коже упругость. В результате дубления между отдельными волокнами коллагена образуются поперечные связи, и возникает более прочная пространственная структура. Дублёная кожа устойчивее к внешним воздействиям и меньше подвержена набуханию.
В качестве дубильных веществ используют органические и неорганические соединения. К органическим относятся таниды, содержащиеся в коре и листьях некоторых деревьев и кустарников, где они образуются из углеводов и фенолов. Больше всего танидов (10,5 %) в коре молодого дуба, из которой делают экстракт, применяемый при дублении
Простейший представитель класса фенолов — соединение, давшее название всему классу, С6Н5ОН. Это бесцветное кристаллическое вещество (tплав=41 °С) с характерным запахом, плохо растворимое в холодной воде. Попав на кожу, фенол вызывает ожоги, поэтому обращаться с ним нужно осторожно.
Источник фенола — каменноугольная смола, из которой он был впервые выделен в 1834 г. В наше время его получают из бензола и пропилена — кумольным способом, разработанным в 1949 г. советским химиком Рудольфом Юрьевичем Удрисом.
По химическим свойствам фенол отличается от спиртов и бензола. Это слабая кислота, и долгое время его называли карболовой кислотой. Фенол обладает бактерицидным действием — он убивает даже самые стойкие бактерии и микроскопические грибки. Поэтому его водный 5-процентный раствор широко применяли для дезинфекции помещений.
Впервые образование блестящих шелковистых кристаллов наблюдал при сухой перегонке смол алхимик Андреас Либавий. Оказалось, что это бензойная кислота C6H5COOH — вещество, в холодной воде плохо растворимое, а в горячей — хорошо. Сама кислота и её сложные эфиры входят в состав многих эфирных масел (например, гвоздичного) и бальзамов. Содержащие бензойную кислоту ягоды брусники и клюквы могут долго храниться, поскольку почти не подвержены гниению. Дело в том, что бензойная кислота убивает болезнетворные бактерии, вызывающие гниение. Благодаря этому свойству, а также нетоксичности бензойную кислоту и её соли (например, бензоат натрия) активно используют в качестве консерванта в пищевой промышленности — добавляют во фруктовые соки, соусы, джемы, безалкагольные напитки.
Учёные XIX в., опиравшиеся только на теорию химического строения А. М. Бутлерова, не смогли решить все загадки молекулы бензола и чётко определить понятие ароматичности. Тогда ароматическим считалось любое органическое вещество, в молекуле которого содержится бензольное ядро. Но уже в начале XX столетия были открыты небензоидные соединения, по свойствам, весьма похожие на бензол и его производные, но не содержащие в своих молекулах бензольного цикла. Этих веществ становилось всё больше, вот почему теория органической химии остро нуждалась в чётких критериях ароматичности того или иного соединения.
Бензол Тиле.
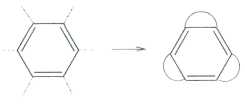
Что такое С6Н6? Любой химик, не задумываясь, скажет — бензол! А собственно, почему? У соединения С6Н6, как и у большинства углеводородов, должны быть изомеры, причём на бензол вовсе не похожие (всего их 217!). А сколько существует валентных изомеров бензола, т. е. таких, которые можно перевести друг в друга, «не трогая» атомы, а лишь за счёт перераспределения между ними химических связей? У всех валентных изомеров бензола каждый атом углерода должен быть соединён только с одним атомом водорода. Некоторые из этих структур предлагались ещё в XIX в. Самые известные — бензол Кекуле (1) и бензол Дьюара (2).
Английский физик и химик Джеймс Дьюар (1842—1923) в 1867 г. выступил на заседании Королевского общества в Эдинбурге с лекцией «Об окислении фенилового спирта и механическом устройстве, иллюстрирующем структуру ненасыщенных углеводородов». Он рассказал об устройстве, состоящем из стержней и шариков, с помощью которых можно конструировать модели органических молекул. Для иллюстрации потенциальных возможностей своего изобретения учёный сконструировал модель «бензола Кекуле», а также ещё несколько изомеров. Один из них — структура (2) — впоследствии получил название «дьюаровского бензола»: некоторые химики полагали, что именно таково строение этого соединения. Правда, сам Дьюар никогда не заявлял, что какая-либо из его моделей может описывать строение «настоящего» бензола.
В сентябре 1886 г. в Берлине проходил съезд естествоиспытателей, к которому приурочили издание журнала, пародирующего самый известный химический журнал того времени — «Berichte der Deutschen Chemischen Gesellschaft» («Доклады Немецкого химического общества»). На обложке вместо слова «Deutschen» было напечатано «Durstigen», что превращало название в «Доклады жаждущего химического общества», иначе говоря, «общества химиков — любителей выпить».
Шутки шутками, но в журнале была опубликована статья «находчивого» господина Финдига «К вопросу о строении бензола», которая фактически предвосхитила теорию Тиле — принцип «остаточных» валентностей у атомов углерода, соединённых двойными связями. «Различные научные дисциплины, — писал автор, — должны помогать друг другу.
Сам Кекуле уверял, что структура бензольного кольца приснилась ему, когда он отдыхал в кресле перед камином. Ровно через 25 лет после этого открытия, когда немецкие химики отмечали «Праздник бензола», учёный так описывал рождение знаменитой формулы:
«...Моя лаборатория находилась в переулочке и даже днём в ней царил полумрак. Для химика, который проводит целые дни в лаборатории, это не было помехой. Я занимался работой над своим „Учебником", но что-то мне мешало, и мои мысли где-то витали. Я повернул кресло к камину и задремал. Атомы принялись танцевать перед моими глазами. На этот раз маленькие группы держались скромно на втором плане. Мой взор, обострённый от повторения одних и тех же образов, обратился скоро к более крупным фигурам различной формы. Длинные нити очень часто сближались и свёртывались в трубку, напоминая двух змей. Но что это? Одна из них вцепилась в собственный хвост, продолжая насмешливо кружиться перед моими глазами. Я внезапно пробудился и на этот раз провёл остаток ночи, чтобы изучить следствия из моей гипотезы».
Вроде бы всё просто. Однако это лишь кажущаяся простота. Кому ещё могут присниться атомы, кружащиеся в танце, как не человеку, длительное время упорно и мучительно размышляющему над связанной с ними проблемой. Открытию Кекуле предшествовала изнурительная научная работа; многие годы он спал по три-четыре часа в сутки. (Он вспоминал: «Одна ночь, проведённая без сна, была не в счёт. Только две или три ночи подряд без сна я считал своей заслугой».) Неудивительно, что именно во время краткого отдыха и произошло важное открытие.
Судя по формуле, бензол — сильно ненасыщенное соединение: по сравнению с насыщенным углеводородом гексаном СбН14, ему «не хватает» восьми атомов водорода! Однако, несмотря на это, для бензола и родственных ему ароматических соединений реакции присоединения («насыщения» атомов углерода) нехарактерны. Так, он не обесцвечивает бромную воду, тогда как соединения С6Н6 со структурой СН2=СН—CºС—СН=СН2 и подобные им реагируют с ней мгновенно. «Насытить» молекулу бензола атомами водорода или галогена удаётся с большим трудом. Например, реакция с хлором СбН6+3Сl2 ®СбНбСl6 идёт только при интенсивном ультрафиолетовом облучении смеси, а водород присоединяется под давлением и при нагревании в присутствии катализаторов, образуя циклогексан С6Н12.
В названиях «бензол», «бензойная кислота», «бензальдегид» один и тот же корень «бенз». История его происхождения очень интересна. В Юго-Восточной Азии, на островах Ява и Суматра растёт дерево, которое выделяет красно-коричневую смолу. Её горение сопровождается приятным запахом. В Средние века арабские торговцы стали вывозить эту смолу для продажи в Европу. Сами купцы называли её яванским ладаном; по-арабски это звучало как «лубан джави» — ладан из Явы.
Европейцам первый слог «лу» напоминал артикли «la» и «le» в итальянском и французском языках. Поэтому они стали называть это вещество «лу банджави», а потом, отбросив мнимый «артикль», — «банджави». Позднее слово произносили и как «бенджами», и как «бенджоин», а примерно с середины XVII в. — как «бензоин».