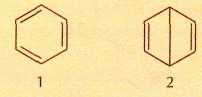
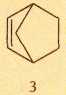
Что такое С6Н6? Любой химик, не задумываясь, скажет — бензол! А собственно, почему? У соединения С6Н6, как и у большинства углеводородов, должны быть изомеры, причём на бензол вовсе не похожие (всего их 217!). А сколько существует валентных изомеров бензола, т. е. таких, которые можно перевести друг в друга, «не трогая» атомы, а лишь за счёт перераспределения между ними химических связей? У всех валентных изомеров бензола каждый атом углерода должен быть соединён только с одним атомом водорода. Некоторые из этих структур предлагались ещё в XIX в. Самые известные — бензол Кекуле (1) и бензол Дьюара (2).
Английский физик и химик Джеймс Дьюар (1842—1923) в 1867 г. выступил на заседании Королевского общества в Эдинбурге с лекцией «Об окислении фенилового спирта и механическом устройстве, иллюстрирующем структуру ненасыщенных углеводородов». Он рассказал об устройстве, состоящем из стержней и шариков, с помощью которых можно конструировать модели органических молекул. Для иллюстрации потенциальных возможностей своего изобретения учёный сконструировал модель «бензола Кекуле», а также ещё несколько изомеров. Один из них — структура (2) — впоследствии получил название «дьюаровского бензола»: некоторые химики полагали, что именно таково строение этого соединения. Правда, сам Дьюар никогда не заявлял, что какая-либо из его моделей может описывать строение «настоящего» бензола.
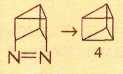
Теоретически с формулой С6Н6 могут существовать шесть валентных изомеров; следовательно, помимо структур Кекуле (1) и Дьюара (2), должно быть ещё четыре. Многие десятилетия все структуры, кроме открытой Кекуле, считали «бумажными изомерами», которые реально существовать не могут. Однако в 1962 г. Э. Э. ван Тамелен и С. П. Паппас из университета в Мэдисоне (штат Висконсин, США), подвергнув ультрафиолетовому облучению раствор производного бензола с тремя трет-бутильными заместителями —С(СН3)3 в диэтиловом эфире, синтезировали вещество, молекула которого, если не указывать заместители в кольце, имеет структуру (2). Полученная бесцветная жидкость при нагревании до 200 °С в течение 15 мин превращалась в исходное соединение. Пять лет спустя К. Э. Вильцбах со своими сотрудниками из химического отдела Аргоннской национальной лаборатории (штат Иллинойс, США), облучая бензол ультрафиолетовым светом, синтезировал бензвален (3).
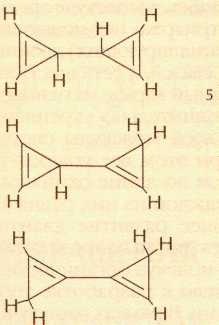
В 1973 г. сотрудники химического факультета университета в городе Колумбия (штат Нью-Йорк) Томас Кац и Нэнси Эктон, облучая ультрафиолетовым светом (и одновременно подогревая) азопроизводное бензвалена, получили призман (4):
Это соединение в течение столетия называли бензолом Ладенбурга, по имени предложившего его структуру немецкого химика-органика Альберта Ладенбурга (1842—1911), хотя и считали эту структуру чисто гипотетической. В призмане углы между углерод-углеродными связями настолько отличаются от привычных тетраэдрических (например, в предельных углеводородах), что он обладает очень большой по сравнению с бензолом избыточной энергией, равной 377 кДж/моль (это больше, чем энергия разрыва углерод-углеродной связи в молекуле этана!). Тем не менее призман стабилен при комнатной температуре, а при 90 °С разлагается наполовину за 11 часов.
В 1989 г. сотрудникам Хьюстонского университета (штат Техас, США) У. Э. Биллупсу и М. М. Хейли удалось, наконец, синтезировать все три возможных бициклопропенила: Бензвален, призман и бициклопропенил, как и дьюаровский бензол, — бесцветные жидкости. После работ Биллупса и Хейли химики полагали, что получен последний валентный изомер бензола — бицикло-проп-2-енил (5). Поэтому в 1991 г. американский химик И. Гутман, читая для студентов Королевской школы в английском городе Кентербери лекцию о бензоле, упомянул, в частности, что у этого соединения есть ещё четыре валентных изомера, последний из которых был лишь недавно синтезирован. Но когда один из студентов спросил, откуда известно, что всего таких изомеров пять (включая и сам бензол), лектор не смог ответить. Вернувшись в свою лабораторию, Гутман решил разобраться в этом вопросе и занялся математическими построениями. В результате выяснилось, что теоретически возможен и шестой (последний) валентный изомер бензола (6): На самом деле этот изомер был предсказан гораздо раньше, ещё в 1966 г., сотрудником Политехнического института в Бухаресте Александром Балабаном. В журнале «Румынское химическое обозрение» исследователь опубликовал статью, где фигурировала структура (6); автор, видимо, в шутку окрестил её «бензмёбиусстрипан». В этом название фигурируют бензол, известная геометрическая структура — лист Мёбиуса и английское слово strip — «лента», «полоска».
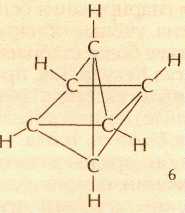
Если изготовить классическую модель последнего валентного изомера бензола, то окажется, что два атома углерода в противоположных вершинах несколько искажённого октаэдра должны быть соединены очень длинной связью, проходящей через центр четырёхчленного цикла, — вероятно, слишком длинной, чтобы подобная структура могла существовать в действительности. Впрочем, и структуры (2—4) тоже долгое время рассматривали как чисто гипотетические...
Похожие статьи