Большинство химических и биохимических процессов с ростом температуры заметно ускоряются. Так, мясо при комнатной температуре испортится гораздо скорее, чем в холодильнике. В странах с влажным тропическим климатом фрукты созревают раньше, а машины ржавеют быстрее,
чем в северных широтах. Железо не реагирует с холодной концентрированной серной кислотой, но растворяется в горячей.
Этот эффект ещё в XIX в. был описан с помощью эмпирического (т. е. выведенного из опытных данных) правила Вант-Гоффа:
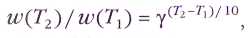
Даже по самому простому уравнению реакции нельзя сказать, является ли она элементарной или нет. Реакцию иода с водородом Н2+I2=2HI долгое время считали элементарной, потому что её скорость описывалась уравнением w = k[H2][I2], характерным для бимолекулярных реакций. Но потом выяснилось, что реакция эта сложная и состоит по меньшей мере из трёх элементарных. На первой стадии молекула иода при нагревании распадается на атомы: 12®k12I. Атомы могут либо опять превратиться в молекулу иода: 2I®k2I2, либо столкнуться с молекулой водорода и образовать две молекулы иодоводорода: 2I+Н2®k3HI
Зависимость концентрации реагента с от времени t для реакции первого порядка А®Р описывается формулой с=с0е-kt (с0 — начальная концентрация исходного вещества А, к — константа скорости реакции). Такая формула называется экспоненциальной, а соответствующая кривая — экспонентой (спадающей). Для реакции второго порядка А+®Р(в простейшем случае равенства концентраций реагентов А и В) скорость описывается уравнением w=dc/dt=-кс2 (знак «минус» показывает, что концентрация уменьшается со временем). Интегрирование этого уравнения дает иную зависимость концентрации реагента А (или В) от времени: 1/с-1/с0=kt, а соответствующая кинетическая кривая имеет гиперболическую зависимость (см. рисунок). Для реакций первого порядка период полупревращения t1/2 — величина постоянная: t1/2 =ln2/к.
Если реакции протекают при столкновении молекул, то скорость реакций должна напрямую зависеть от числа этих столкновений, которое можно рассчитать на основе молекулярно-кинетической теории. Число встреч двух частиц х и у в единицу времени прямо пропорционально произведению их концентраций: z=const [x] [у], где постоянная (const) зависит от температуры, массы и размера сталкивающихся частиц.
Встречи двух частиц длятся не более 10-12 с, частота же двойных соударений
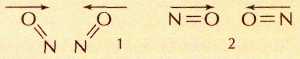
Столкновение двух молекул NO: 1 — хорошая ориентация для образования молекулы димера O=N—N=O(молекулы расположены «лицом» друг к другу); 2 — плохая ориентация («спиной» друг к другу).
Для того чтобы количественно описать зависимость скорости от концентрации, надо понять, как «устроены» химические реакции.
Они редко бывают простыми. Как правило, реакция состоит из сложной последовательности отдельных стадий. Например, окисление фосфина подкисленным раствором перманганата калия описывается ионным уравнением 5РН3+8МnО-4+19Н+=5Н2РО-4+8Мn2++12Н2О. В левой части уравнения — 32 частицы. Ясно, что все они не способны встретиться одновременно. Они реагируют друг с другом поочерёдно, объединяясь в промежуточные частицы, которые в свою очередь взаимодействуют с исходными веществами, образуя продукты реакции или другие промежуточные частицы.
Но процесс разделения сложной реакции на более простые не может продолжаться бесконечно. Есть такие реакции, которые уже не «упрощаются». Их называют элементарными.
Одна из основных задач химической кинетики -- управление скоростью реакции. Полезные реакции нужно заставить идти быстрее, а вредные — замедлить. Для этого надо знать, какие факторы влияют на их скорость.
Все химические превращения в растворе или в газовой фазе (за исключением инициируемых светом) происходят при столкновении молекул. Чем чаще молекулы встречаются, тем быстрее идёт взаимодействие. Число же столкновений, а следовательно и скорость реакции, зависит от числа молекул в единице объёма, т. е. от концентраций реагирующих веществ.
Если бы при каждом столкновении молекулы вступали во взаимодействие, все химические реакции заканчивались бы мгновенно, многие — со взрывом. На самом деле некоторые молекулы при столкновении превращаются в продукты реакции, а другие — нет. От чего это зависит?
Дело в том, что для разрыва или ослабления старых химических связей нужна энергия. Когда сталкиваются активные молекулы, которые обладают некоторым запасом энергии, они могут прореагировать. Если же энергия мала, то столкновение не приводит к реакции и молекулы разлетаются без химического превращения. Энергия молекул в свою очередь зависит от температуры. Это и есть второй важнейший фактор, определяющий скорость реакции. Подавляющее большинство реакций ускоряется с ростом температуры.
Золотые украшения сохраняют свою красоту и блеск веками. А вот брошенный на улице старый автомобиль спустя несколько лет превращается в груду ржавого металлолома; долька яблока уже через несколько часов покрывается бурой плёнкой; петарда, брошенная в костёр, оглушительно взрывается.
Любопытно, что с точки зрения химической термодинамики возможны все перечисленные процессы, даже окисление золота. Просто у них разные скорости. Одной реакции требуются для завершения микросекунды, другой — миллионы лет. Почему так? Термодинамика ответить бессильна: в этой теории не учитывается время. Скорости химических реакций изучает химическая кинетика. Более того, химическая кинетика даёт ключ к управлению реакцией.
Полученный критерий самопроизвольного протекания реакции можно преобразовать в более удобную форму, если воспользоваться ещё одной термодинамической функцией — энергией Гиббса, которая обозначается буквой G и определяется как G=Н-TS. Названа она в честь одного из основателей химической термодинамики, американского учёного Джозайи Уилларда Гиббса (1839—1903).
Преобразуем выражение DSобщ =DSсист-DHсист/T>0, умножив его на -Т. Получим:
-TDSобщ=-TDSсист+DH<0. С учётом новой функции G последнее выражение приобретает вид -TDSобщ=DGсист<0.
Теперь критерий самопроизвольности реакции и её равновесия можно выразить через изменение энергии Гиббса системы;
DG<0 — самопроизвольная реакция;
DG=0 — реакция находится в состоянии равновесия;
DG>0 — несамопроизвольная реакция (самопроизвольна обратная реакция).
Итак, энтропия — мера хаотичности, беспорядка. А наиболее хаотичной формой существования вещества является газ. Поэтому если химическая реакция протекает с увеличением числа молей газов в системе, то энтропия системы возрастает, и наоборот. Например, энтропия сильно увеличивается в реакции СаСО3=СаО+СО2 и уменьшается в реакции 2Н2+О2=2Н2О.
Энтропия — царица хаоса.
Критерий самопроизвольности процесса устанавливается вторым законом термодинамики. Он имеет несколько формулировок, равнозначность которых не всегда очевидна на первый взгляд. Интересна история открытия этого закона.
В 1824 г. французский физик Никола Леонар Сади Карно (1796—1832) в своей единственной опубликованной работе «Размышления о движущей силе огня и о машинах, способных развивать эту силу» описал идеальную тепловую машину, позволяющую получать максимальную работу за счёт использования теплоты. Он сделал важный вывод: для получения работы недостаточно иметь только источник теплоты (нагреватель), но необходим ещё и её приёмник. Карно утверждал, что тепловые машины совершают работу не за счёт расхода теплорода, а за счёт его перехода от горячего тела к холодному, подобно тому как падение воды с высоты приводит в движение турбину (о теплороде рассказано в статье «Тепло химических реакций»). Коэффициент же полезного действия тепловой машины зависит исключительно от разности температур нагревателя и теплоприёмника.
Для описания степени беспорядка используется особая термодинамическая функция, называемая энтропией и обозначаемая буквой S. Это понятие (от греч. «эн» — «в», «внутрь» и «тропе» — «поворот», «превращение») ввёл немецкий физик Рудольф Клаузиус в 18б5 г. «Слово „энтропия", — писал он, — я намеренно подобрал ближе к слову „энергия", так как обе соответствующие этим выражениям величины настолько близки по своему смыслу, что они, по моему мнению, требуют однородного обозначения».
Почему же природа ведёт себя таким образом, что необратимость всех процессов связана именно с рассеянием энергии?
Чтобы ответить на этот вопрос, необходимо переместиться в мир атомов и молекул. Даже в состоянии термодинамического равновесия частицы ни на мгновение не прекращают своего беспорядочного движения. Их скорости и положения в пространстве постоянно меняются. Другими словами, одному макроскопическому состоянию соответствует великое множество микроскопических состояний — различных вариантов положений всех частиц в пространстве и их скоростей. Число микросостояний называется термодинамической вероятностью W и характеризует неупорядоченность, хаотичность системы.
Молекулярную природу энтропии раскрыл австрийский физик Людвиг Больцман (1844—1906). Связь энтропии с молекулярным хаосом он описал формулой S=klnW, где k — постоянная величина, называемая константой Больцмана, которая связана с газовой постоянной соотношением k=R/NA (NA — постоянная Авогадро) и равна 1,38•10-23 Дж/К
Марселен Бертло и датский химик Ханс Петер Юрген Юлиус Томсен (1826—1909) предположили, что самопроизвольно могут протекать только экзотермические (сопровождающиеся выделением теплоты) реакции. Действительно, как показывает опыт, такие реакции обычно идут самопроизвольно. Однако критерий Бертло—Томсена оказался неверным, поскольку впоследствии стали известны и самопроизвольные эндотермические (протекающие с поглощением теплоты) реакции, которые чаще всего идут при высоких температурах. Таким образом, в природе существует некий общий закон, определяющий направление самопроизвольных процессов.
В чём же его суть?
