Для того чтобы количественно описать зависимость скорости от концентрации, надо понять, как «устроены» химические реакции.
Они редко бывают простыми. Как правило, реакция состоит из сложной последовательности отдельных стадий. Например, окисление фосфина подкисленным раствором перманганата калия описывается ионным уравнением 5РН3+8МnО-4+19Н+=5Н2РО-4+8Мn2++12Н2О. В левой части уравнения — 32 частицы. Ясно, что все они не способны встретиться одновременно. Они реагируют друг с другом поочерёдно, объединяясь в промежуточные частицы, которые в свою очередь взаимодействуют с исходными веществами, образуя продукты реакции или другие промежуточные частицы.
Но процесс разделения сложной реакции на более простые не может продолжаться бесконечно. Есть такие реакции, которые уже не «упрощаются». Их называют элементарными.
Существует два основных типа элементарных реакций: мономолекулярные, когда в реакции участвует один реагент:
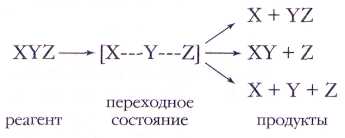
и бимолекулярные (два реагента):
К мономолекулярным относятся некоторые реакции разложения, в частности СН3—N=N—СН3®С2Н6+ N2, и изомеризации: СН3СН2СН2СН3®CH3CH(CH)2.
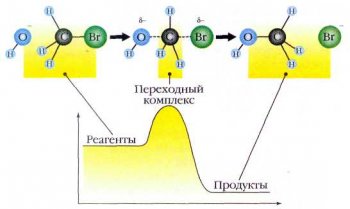
Пример бимолекулярной реакции — столкновение атомов водорода с молекулами хлора: Н+Сl2®НСl + Сl. Это одна из стадий сложной реакции водорода с хлором, которая описывается суммарным уравнением Н2+Сl2=2НСl.
Если две частицы встретились и не разлетелись сразу же, а задержались вместе на какое-то время, то с ними может столкнуться третья частица. Такое исключительно редкое «тройное столкновение» способно привести к тримолекулярной реакции, например 2NO+Сl2=2NOCl.
Чем выше концентрация соляной кислоты, тем быстрее протекает растворение в ней металлического цинка.
Механизм бимолекулярной реакции.
Больше трёх частиц одновременно столкнуться не могут, поэтому других элементарных реакций не бывает.
Теория столкновений помогает понять, как влияет концентрация на скорость элементарных реакций. Для них эта зависимость выражается законом действующих масс:
Скорость элементарной реакции пропорциональна произведению концентраций реагирующих молекул.
Этот закон экспериментально подтвердили в 1867 г, норвежские учёные — математик Като Максимилиан Гульдберг (1836—1902) и химик Петер Вааге (1833—1900), изучавшие обратимые реакции. Они доказали, что скорость реакций до установления равновесия пропорциональна «действующим массам» (как в то время называли концентрации) исходных веществ. Интересно, что Гульдберг и Вааге опубликовали свою работу на норвежском языке, и она оставалась незамеченной до тех пор, пока через 12 лет её не перевели на немецкий.
В зависимости от числа молекул, участвующих в элементарной реакции, закон действующих масс может иметь следующий вид:
w=k•[X] — для мономолекулярных,
w=k•[X]•[Y] — для бимолекулярных,
w=k•[X]•[Y]•[Z] — для тримолекулярных реакций.
Коэффициент пропорциональности k между скоростью и произведением концентраций называют константой скорости. Эта величина не зависит от концентраций, но на неё влияют температура и природа реагирующих веществ.
Сумму показателей степеней при концентрациях веществ называют общим порядком реакции. Показатели степеней при концентрациях в законе действующих масс равны единице только в случае элементарных реакций. Мономолекулярные реакции имеют первый порядок, бимолекулярные — второй, тримолекулярные — третий. Часто «докопаться» до элементарной стадии химического процесса очень непросто, и общий порядок реакции устанавливают экспериментально, определяя вид зависимости скорости реакции от концентрации данного реагента. Для процессов, механизм которых известен, можно также математически рассчитать общий порядок реакции, но это довольно сложная задача.
Чтобы найти зависимость концентраций реагентов от времени, на-
до решить дифференциальное уравнение. Например, все реакции первого порядка описываются дифференциальным уравнением -dc/dt=kс, где с — текущая концентрация вещества. Это уравнение имеет точное решение c(t) = со-е-kt (е=2,71828... — основание натуральных логарифмов, с0 — концентрация при t=0).
В реакциях первого порядка концентрация вещества убывает по экспоненциальному закону: за равные промежутки времени распадается равная доля вещества. Так, за время, равное t1/2=ln2/k, всегда распадается ровно половина, поэтому tl/2 называют периодом полупревращения вещества
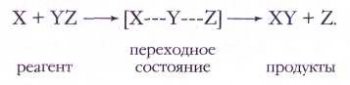

Похожие статьи