Если реакции протекают при столкновении молекул, то скорость реакций должна напрямую зависеть от числа этих столкновений, которое можно рассчитать на основе молекулярно-кинетической теории. Число встреч двух частиц х и у в единицу времени прямо пропорционально произведению их концентраций: z=const [x] [у], где постоянная (const) зависит от температуры, массы и размера сталкивающихся частиц.
Встречи двух частиц длятся не более 10-12 с, частота же двойных соударений
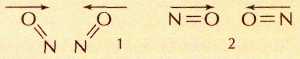
Столкновение двух молекул NO: 1 — хорошая ориентация для образования молекулы димера O=N—N=O (молекулы расположены «лицом» друг к другу); 2 — плохая ориентация («спиной» друг к другу).
между молекулами газов огромна. Так, при нормальных условиях в 1 см3 воздуха происходит примерно 1028 столкновений молекул азота и кислорода, однако они друг с другом не взаимодействуют, поскольку не обладают достаточной для этого энергией. Для некоторых реакций имеет значение не только уровень энергии молекул, но и то, каким образом они окажутся ориентированы по отношению друг к другу в момент столкновения.
Основное уравнение теории столкновений описывает константу скорости бимолекулярной реакции с учётом всех перечисленных факторов:
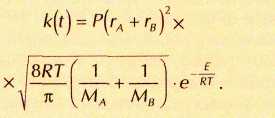
Здесь первый множитель Р (пространственный) учитывает вероятность правильной ориентации молекул, второй и третий — частоту столкновений: она пропорциональна плошали сечения молекул и их средней скорости, квадрат которой пропорционален температуре и обратно пропорционален массе молекулы (r и M — радиус и молярная масса).
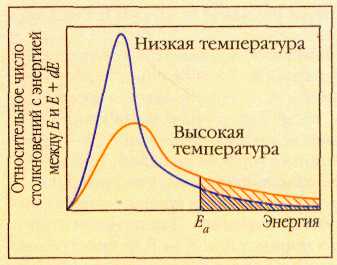
При повышении температуры доля молекул, энергия которых превышает значение энергии активации, быстро растёт.
Третий множитель в этой формуле учитывает долю активных молекул (E — энергия, необходимая для реакции).
Похожие статьи