Борную кислоту, а иногда и её натриевую соль — буру — можно найти во многих домашних аптечках как в чистом виде, так и в составе мазей, спиртового раствора — «борного спирта», полосканий для горла и т. п. И если к буре отношение обычно несколько настороженное (всё-таки это вещество используют как яд для тараканов), то борную кислоту считают вполне безобидной. В справочниках по лекарственным средствам, выпушенных миллионными тиражами, можно прочитать, что борную кислоту «применяют... как антисептическое средство в виде водных растворов (2—4%) для полоскания полости рта, зева и для промывания глаз; назначают также в виде мази (5—10%) и в присыпках при заболеваниях кожи». Борную кислоту веками признавали абсолютно безопасным средством и без колебаний использовали как антисептик даже для новорождённых. До сих пор многие мамы и бабушки по традиции применяют раствор борной кислоты, чтобы промыть ребёнку глаза, не ведая, что... травят его ядом!
Борная кислота на самом деле яд; и хотя он слабый, но имеет весьма коварные свойства. Соединения бора действуют не на отдельные виды микроорганизмов, как антибиотики, а на все сразу, поскольку бор является так называемым общеклеточным ядом. А коварство его в том, что этот яд не имеет никаких противоядий и чрезвычайно медленно выводится из организма. Даже взрослый человек при абсолютно здоровых почках за неделю теряет примерно лишь пятую часть попавшего в организм бора. Бор поражает не только желудочно-кишечный тракт, но и кожу, почки, центральную нервную систему. Последнее сопровождается судорогами и может окончиться даже параличом. Недаром применение борной кислоты для приёма внутрь было повсеместно запрещено ещё в конце XIX в. А ведь до этого борная кислота применялась очень широко.
Нитрид бора BN по структуре подобен углероду: в обоих веществах (в равных молярных количествах) содержится одинаковое число электронов. Как и углерод, нитрид бора существует в двух формах, построенных аналогично алмазу и графиту. При взаимодействии оксида бора с аммиаком в присутствии сажи при температуре порядка 2000 °С образуется нитрид бора со структурой графита: В2О3+3С+2NH3=2BN+3СО+3Н2. При высоких давлениях он переходит в алмазоподобную модификацию — боразон.
На основе нитрида бора созданы огнеупорные материалы, в том числе термостойкое волокно. Разные модификации нитрида бора используют как смазку для подшипников и как сверхтвёрдый абразивный материал — порошкообразное вещество, служащее для механической обработки металлов, сплавов, камней и т. п.
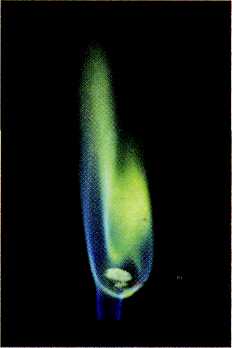
Обнаружить присутствие бора в веществе несложно: летучие соединения бора окрашивают пламя в зелёный цвет. В этом можно убедиться, внеся в пламя горелки несколько кристалликов борной кислоты.
Хотя элемент бор встречается в природе сравнительно редко (в земной коре его почти в 7 тыс. раз меньше, чем алюминия), главным образом в виде солей борной кислоты, бура — кристаллогидрат тетрабората натрия Na7B4O7•10Н2О — была известна уже в раннем Средневековье. В сочинениях арабских алхимиков говорится об использовании её в качестве плавня, а также для пайки драгоценных металлов. С Памира и с отрогов Гималаев буру доставляли караванами в Багдад.
Долгое время состав буры оставался неизвестным. Лишь в 1702 г. ученик Роберта Бойля Вильгельм Гомберг (1662—1715), прокаливая буру с железным купоросом, получил борную кислоту Н3ВО3, которую назвал успокоительной солью (sal sedativum) no будто бы производимому ею действию. Это вещество нашло широкое применение в медицине того времени. Спустя полвека было доказано, что бура является солью борной кислоты: она образуется при взаимодействии «успокоительной соли» с содой Na2CO3.
Цемент (от лат. caementum — «битый камень») — это порошкообразный материал, при смешивании с водой образующий пластичную массу (цементное тесто), которая при затвердевании превращается в камневидную структуру. Обычный, так называемый портландцемент состоит из силикатов и алюмосиликатов кальция: Ca3SiO5, Ca2SiO4, Ca3(AlO3)2 и др. Эти соединения образуются при спекании известняка с кварцевым песком и глиной во вращающихся печах при температуре порядка 1500 °С:
3СаСО3+SiO2=Ca3SiO5+3СО2
8СаСО3+Al2O3 •2SiO2•2Н2О = Са3(АlO3)2+Ca2SiO4+Ca3SiO5+2Н2О+8СО2.
Смешанный с водой цемент постепенно затвердевает (схватывается), что связано с протеканием процессов гидратации и гидролиза силикатов и алюминатов кальция:
Ca3SiO5+3Н2О=Ca2SiO4•2Н2О+Са(ОН)2
Ca2SiO4+2Н2О=Ca2SiO4•2Н2О Са3(АlO3)2+6Н2О=Са3(АlO3)2•6Н2О.
Для полного затвердевания цементного теста требуется три-четыре недели. В строительстве широко используется бетон (от лат. bitumen — «горная смола») — смесь цементного теста с песком и щебнем. Бетон закладывают в специальные деревянные формы, в которых он постепенно затвердевает. Для увеличения прочности конструкций в формы помешают арматуру — стальной каркас. Такой материал называется железобетоном. Магнезиальный цемент получают смешением оксида магния с концентрированным раствором хлорида магния. При затвердевании смеси образуется полимер состава HOMgO(—MgO—)nMgCl, из которого обычно делают подоконники, ступени лестниц.
Гидроксиды кальция, стронция и бария — щёлочи, хотя растворимость Са(ОН)2 и Sr(OH)2 при комнатной температуре низкая. У гидроксида кальция она падает с ростом температуры: наибольшей концентрации удаётся достичь, насыщая Са(ОН)2 ледяную воду (растворимость при О °С составляет 0,173 г на 100 г воды, при 20 °С — 0,166 г, а при 100 °С — 0,08 г). Насыщенный раствор Са(ОН)2 называется известковой водой.
Гидроксид бария растворяется значительно лучше (4,3 г на 100 г воды при 20 °С), причём при повышении температуры его растворимость резко возрастает (при 80 °С — 101,5 г на 100 г воды). Этим свойством пользуются для перекристаллизации вещества: медленно охлаждая насыщенный при 80 °С раствор, получают красивые пластинчатые кристаллы кристаллогидрата Ва(ОН)2•8Н2О. По аналогии с известковой водой насыщенный раствор гидроксида бария называется баритовой водой.
Кристаллогидрат Ва(ОН)2•8Н2О.
Известняковый обрыв. Река Белая. Башкирия.
Название «кальций» происходит от латинского calx — «известь». Так алхимики называли продукты обжига различных веществ. Древние римляне использовали известь для приготовления строительных растворов. Для этого мрамор или известняк (карбонат кальция) подвергали обжигу, получая при температуре порядка 900 — 1000 °С негашёную известь — оксид кальция: СаСО3 ®t°СаО+СО2. Затем известь гасили — заливали водой: СаО+Н2О=Са(ОН)2. Продуктом реакции является гашёная известь, или пушонка (гидроксид кальция), без которой и ныне не обходятся строители. Производство этого вещества описал ещё Плиний Старший в «Естественной истории». Издавна в строительстве используется также гипс — дигидрат сульфата кальция CaSO4•2Н2О. При нагревании Кальций (tпл=839 °С), стронций (tпл=768 °С) и барий (tпл=727 °С) — пластичные металлы серебристо-белого цвета. Из-за достаточной твёрдости их невозможно резать ножом, как натрий или калий.
Последним из щёлочноземельных металлов был открыт радий, для которого ещё А. И. Менделеев «зарезервировал» клетку в периодической системе. Радий обнаружили в 1898 г. в урановой смоляной руде. Исследовавшие минерал супруги Пьер и Мария Кюри установили: некоторые образцы руды имеют большую радиоактивность, чем следовало ожидать, судя по количеству содержащегося в них урана. Учёные сделали вывод, что в состав урановой смолки входит новый элемент, по радиоактивности превосходящий уран. Вскоре удалось выделить его соединения. Элемент назвали радием, чтобы подчеркнуть его способность к радиоактивному распаду. Переработав почти тонну урановой руды, супруги Кюри выделили около 0,1 г соли радия, а металлический радий был получен в 1910 г. при электролизе раствора хлорида радия с ртутным катодом.
Радий представляет собой тяжёлый тугоплавкий металл (tпл=969 °С при давлении 6,5•10-4 атм) серебристо-белого цвета. В свободном виде он, как и другие щёлочноземельные металлы, обладает высокой химической активностью, энергично реагирует с водой с выделением водорода: Ra+2Н2О=Ra(OH)2+Н2. Образующийся при этом гидроксид радия — сильное основание, хорошо растворимое в воде. При действии на него раствором сульфата натрия выпадает белый осадок сульфата радия, нерастворимый в кислотах: Ra(OH)2+Na2SO4=RaSO4¯+2NaOH.
В природе радий образуется при радиоактивном распаде 238U, поэтому неудивительно, что добывают его из урановой руды. Период полураспада изотопа 226Ra — 1600 лет, при этом образуется радиоактивный газ радон: 22688Ra®22286Rn+42Не.
Соединения магния участвуют в формировании костей, в регуляции работы нервной ткани, обмене веществ. Ежедневно человеку требуется примерно 300 — 400 мг этого элемента. Он попадает в наш организм с хлебом, в 100 г которого содержится 90 мг магния, крупой (в 100 г овсяной крупы — 116 мг магния). В молочных продуктах этот элемент присутствует в легко усвояемой форме — в виде растворимого в воде цитрата магния (соли лимонной кислоты). Особенно богаты магнием орехи: на 100 г приходится до 230 мг этого элемента.
К семейству щёлочноземельных элементов, как уже отмечалось, относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами.
Магний входит в состав активного центра зелёного пигмента растений — хлорофилла.
Магний был открыт при анализе воды, взятой из минерального источника вблизи города Эпсом в Англии. Горькая на вкус, она привлекла внимание исследователей в конце XVII в. При упаривании такой воды на стенках сосуда образовывалась белая корка вещества, которое назвали горькой, или эпсомской, солью MgSO4•7Н2О. Её использовали в качестве слабительного. Примерно в то же время учёные заинтересовались и белой магнезией — карбонатом магния MgCO3. При его нагревании образуется жжёная магнезия — оксид MgO. Это вещество А. Л. Лавуазье ошибочно причислил к простым телам, которые уже не могут быть далее разложены.

В состав многих пудр и присыпок входит порошок талька — сложного силиката магния состава 3MgO•4SiO2•Н2О. Тальк относится к самым мягким природным минералам. Его кристаллы легко узнать по перламутровому блеску. Они жирны на ощупь и часто окрашены в зеленоватый цвет (благодаря примесям соединений никеля).
Многие минералы бериллия — берилл 3ВеО•Аl2О3•6SiO2, хризоберилл ВеАl2О4 и их разновидности (изумруд, аквамарин, александрит) — известны давно; эти драгоценные камни упоминаются в произведениях античных авторов. На Руси берилл называли вируллионом, под таким именем он встречается в Изборнике Святослава (1073 г.).
Бериллы и изумруды, выращенные гидротермальным способом.
В главную подгруппу второй группы периодической системы элементов наряду с семейством щёлочноземельных металлов (оно включает близкие по свойствам кальций, стронций, барий и радий) входят два типических элемента — бериллий и магний.
*Типическими Д. И. Менделеев назвал элементы первого, второго и третьего периодов — они наиболее ярко выражают характерные свойства элементов данной подгруппы.
Если магний по свойствам во многом тяготеет к щёлочноземельным элементам, то бериллий стоит как бы особняком. Кажется, что он попал в эту компанию, лишь подчиняясь правилу валентности, поскольку, как и другие элементы группы, в своих соединениях двухвалентен. По свойствам же бериллий гораздо ближе к алюминию, расположенному по диагонали от него в третьей группе. Химики так и говорят: диагональное сходство двух элементов. Причём сходство это настолько сильное, что и встречаются эти элементы часто вместе, в одном соединении.



