К семейству щёлочноземельных элементов, как уже отмечалось, относят кальций, стронций, барий и радий. Д. И. Менделеев включал в это семейство и магний. Щёлочноземельными элементы именуются по той причине, что их гидроксиды, подобно гидроксидам щелочных металлов, растворимы в воде, т. е. являются щелочами.
Магний входит в состав активного центра зелёного пигмента растений — хлорофилла.
Кристаллы гипса.
«...Земельными же они названы потому, что в природе они встречаются в состоянии соединений, образующих нерастворимую массу земли, и сами в виде окисей (оксидов. — Прим. ред.) RO имеют землистый вид», — пояснял Менделеев в «Основах химии».
По распространённости в земной коре кальций занимает пятое место (4,1 % по массе), уступая лишь кислороду, кремнию, алюминию и железу. В природе он встречается в виде гипса CaSO4•2Н2О, флюорита CaF2, апатита Са5(РО4)3(ОН) и кальцита СаСО3 (карбоната кальция, образующего залежи мела, мрамора и известняка). Кальцит сформировался из панцирей древних простейших и моллюсков (кораллов), поэтому неудивительно, что иногда в известняках находят ракушки или отпечатки животных.
В организме человека содержится в среднем около 1 кг кальция, который в форме ортофосфата входит в состав костной ткани. Почти 80 % потребности в этом элементе удовлетворяется за счёт молочных продуктов. В них кальций присутствует в виде солей фосфорной и лимонной кислот, причём фосфат кальция находится в молоке в комплексе с белком казеином (казеинкальцийфосфатный комплекс). В литре молока или кефира как раз и содержится средняя суточная норма — 1,2 г кальция. При недостатке кальция в организме врачи назначают его препараты, например глюконат кальция — соль глюконовой кислоты (продукта окисления альдегидной группы глюкозы до карбоксильной).
Металлический кальций был впервые получен Г. Дэви в 1808 г. при электролизе смеси влажной гашёной извести Са(ОН)2 с оксидом ртути HgO. В качестве катода учёный использовал капельку металлической ртути, помещённую в смесь.
Стронций и барий распространены в природе значительно меньше, чем кальций. Стронций встречается в виде минерала целестина (от лат. caelestis — «небесный») — сульфата стронция SrSO4, образующего красивые розово-красные или бледно-голубые кристаллы, а барий — в виде барита (тяжёлого шпата) BaSO4.
Стронций получил название от шотландской деревни Стронциан, близ которой в конце XVIII в. был найден редкий минерал стронцианит SrCO3.
Годом открытия бария можно считать 1774 г., когда шведский химик Карл Вильгельм Шееле (1742—1786) и его ученик Юхан Готлиб Ган (1745—1818) установили, что в тяжёлом шпате содержится новая земля. Она получила название «барит» (от греч. «барис» — «тяжёлый»), а образующий её элемент — «барий». В виде простых веществ барий и стронций были выделены Г. Дэви в 1808 г.
С пищей и питьевой водой человек ежедневно получает около 15— 20 мг стронция. В большем количестве соединения этого элемента вредны для здоровья. Ионы стронция способны замещать в костях ионы кальция, что приводит к болезням. Поэтому предельно допустимая концентрация ионов Sr2+ в питьевой воде — 7 мг/л.
Растворимые соединения бария ещё более токсичны. Симптомы отравления ими появляются при приёме внутрь примерно 0,2 г растворимой соли. А доза 0,8—0,9 г уже смертельна. В случае отравления надо принимать 10-процентный раствор сульфата натрия или сульфата магния. При этом в организме образуется сульфат бария BaSO4 — нерастворимый и потому безопасный.

Целестин.
при температуре около 500 °С, то реакция будет протекать дальше:

Образовавшийся пероксид бария при 700 °С отщепляет избыточный кислород, вновь переходя в оксид. Таким образом, имея немного оксида бария, можно выделять из воздуха чистый кислород. Именно так и поступали в старину, когда ещё не научились сжижать воздух.
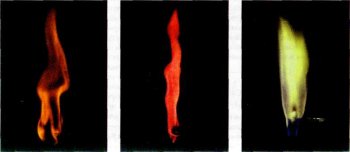
Летучие соединения щёлочноземельных металлов придают пламени характерный цвет: соединения кальция — кирпично-красный, стронция — карминово-красный, а бария — желтовато-зелёный. Не случайно нитраты этих металлов используют в пиротехнике.
Щёлочноземельные металлы выделяют либо алюмотермией:
4СаО + 2Аl®t °СаАl2О4+3Са,
либо электролизом расплавов хлоридов. Практическое значение из них имеет в основном кальций — он используется в металлургии в качестве раскислителя.
Соединения кальция, стронция и бария применяются в разных отраслях промышленности, в строительстве. Так, из гашёной извести, кварцевого песка SiO2 и воды делают известковый раствор, который постепенно поглощает из воздуха углекислый газ и медленно затвердевает. При этом протекают процессы образования малорастворимых солей кальция:
Са(ОН)2+СО2=CaCO3¯+Н2О
2Са(ОН)2+SiO2=Ca2SiO4¯+2Н2О.
Очень полезным веществом оказался сульфат бария. В конце XIX в. им разбавляли дорогие свинцовые белила, а ныне на основе BaSO4 разработана белая краска литопон, обладающая высокой кроющей способностью, что снижает её расход. Сульфат бария также добавляют в бумагу дорогих сортов (для денежных знаков, документов).
Как и другие элементы с высоким порядковым номером, барий способен поглощать рентгеновское излучение. Поэтому BaSO4 используется при изготовлении защитных материалов для рентгеновских установок и при диагностике заболеваний желудочно-кишечного тракта. Перед обследованием больного угощают «кашицей» из сульфата бария. Не навредит ли это пациенту? К счастью, сульфат бария очень плохо растворим в воде (0,00029 г в 100 г воды при 30 °С), а следовательно, и не опасен для человека.



Похожие статьи