Гидроксиды кальция, стронция и бария — щёлочи, хотя растворимость Са(ОН)2 и Sr(OH)2 при комнатной температуре низкая. У гидроксида кальция она падает с ростом температуры: наибольшей концентрации удаётся достичь, насыщая Са(ОН)2 ледяную воду (растворимость при О °С составляет 0,173 г на 100 г воды, при 20 °С — 0,166 г, а при 100 °С — 0,08 г). Насыщенный раствор Са(ОН)2 называется известковой водой.
Гидроксид бария растворяется значительно лучше (4,3 г на 100 г воды при 20 °С), причём при повышении температуры его растворимость резко возрастает (при 80 °С — 101,5 г на 100 г воды). Этим свойством пользуются для перекристаллизации вещества: медленно охлаждая насыщенный при 80 °С раствор, получают красивые пластинчатые кристаллы кристаллогидрата Ва(ОН)2•8Н2О. По аналогии с известковой водой насыщенный раствор гидроксида бария называется баритовой водой.
Кристаллогидрат Ва(ОН)2•8Н2О.
Гидроксиды щелочных металлов всегда содержат примесь нерастворимого в воде карбоната, поскольку активно поглощают из атмосферы углекислый газ. Помутнение известковой воды — простейшая качественная реакция на это вещество: Са(ОН)2+СО2=CaCO3¯+H2O. При дальнейшем пропускании углекислого газа осадок карбоната кальция растворяется, превращаясь в растворимую кислую соль — гидрокарбонат кальция: СаСО3+СО2+Н2О = Са(НСО3)2.
Подземные воды, насыщенные растворённым углекислым газом, просачиваясь сквозь пласты известняков, постепенно растворяют их, образуя пещеры. Гидрокарбонат кальция в свою очередь вновь переходит в карбонат (реакция легко протекает при нагревании или при добавлении щёлочи):
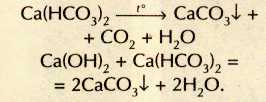
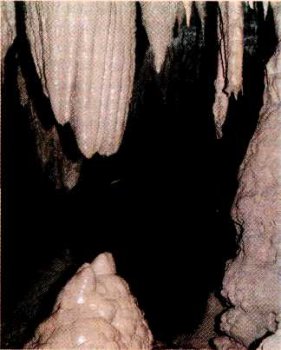
С этим связано интересное явление природы. Вода, попадая в подземные пещеры в известковых породах, постепенно вновь выделяет известняк. В результате на сводах пещер растут сталактиты — сосульки, которые по мере стекания по ним воды удлиняются в толстые стержни. Навстречу им снизу поднимаются сталагмиты: они образуются из воды, падающей каплями на дно пещеры. Со временем сталагмиты нередко срастаются со сталактитами, становясь похожими на колонны. В таком сталактитовом «лесу» можно найти «деревья», достигающие в высоту тридцати метров.
В отличие от гидроксидов натрия и калия, гидроксиды щёлочноземельных металлов при нагревании разлагаются: Са(ОН)2 отщепляет воду при 580 °С, Sr(OH)2 — при температуре выше 400 °С, а Ва(ОН)2 — лишь при 800 °С.

Похожие статьи