Шестую группу элементов периодической системы завершает элемент полоний (от лат. Polonia — «Польша»), обнаруженный в 1898 г. Марией Склодовской-Кюри в урановой смоляной руде. Он был назван в честь родины исследовательницы.
Полоний представляет собой мягкий серебристо-серый металл (tпл=254 °С, tкип=962 °С). Все его изотопы радиоактивны, наиболее долгоживущий 209Ро имеет период полураспада 102 года.
Полоний — активный металл: он взаимодействует с соляной кислотой с выделением водорода: Ро+2HCl=PoCl2+Н2. Образующийся в результате реакции хлорид полония (II) (раствор красного цвета) легко окисляется до хлорида полония (IV) (жёлтый раствор).
Изотоп полония 210Ро используется в атомных батареях космических аппаратов в качестве источника энергии.
Селен был открыт в 1817 г. Й. Я. Берцелиусом в отходах сернокислотного производства. Наименование своё, образованное от греческого «селене» — «луна», элемент получил по аналогии с теллуром, который был выделен 40 годами ранее из золотоносной руды и назван в честь «матери Земли» (от лат. tellus — «земля», «планета»).
Селен существует в нескольких аллотропных формах. Наиболее устойчивым является серый селен — твёрдое вещество с металлическим блеском и свойствами полупроводника (tпл=217 °C, tкип=685 °C. Crорая на воздухе, он образует оксид SeO2 — белый порошок, легкорастворимый в воде; его водный раствор — слабая селенистая кислота H2SeO3.
Киноварь — сульфид ртути HgS — издревле использовалась в качестве ярко-красной краски. Этот минерал редко встречается в природе, поэтому уже в Средние века киноварь получали искусственно. Приведём описание этого процесса, взятое из «Малого алхимического свода» Альберта Великого (XIII в.): «Киноварь делают из ртути и серы так. Возьми две части ртути, а третьей частью да будет сера. Смесь размельчи... Помести в стеклянный сосуд с узким горлом. Обмажь верх сосуда слоем глины толщиной в палец и, высушив, поставь сосуд на треножник. ещё раз проверь, хорошо ли закупорен сосуд, и полдня нагревай на медленном огне.
Потом усиль огонь, прокаливая уже целый день, покуда не углядишь красные дымы, кои воскурятся над сосудом (пары киновари — она летуча. — Прим. ред.). Охлади, а потом и вскрой сосуд, вынув из него содержимое. Добрая и ясная киноварь будет этим содержимым. Итак, работа завершена, а истина — в твоих руках».
Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей разнообразное практическое применение. Куски самородной серы использовались для совершения обряда изгнания злых духов. Так, по легенде, Одиссей, возвратившись в родной дом после долгих странствий, первым делом велел окурить его серой. Много упоминаний об этом веществе встречается в Библии.
В Средние века сера занимала важное место в арсенале алхимиков. Как они считали, все металлы состоят из ртути и серы: чем меньше серы, тем благороднее металл. Практический интерес к этому веществу в Европе возрос в XIII—XIV вв., после появления пороха и огнестрельного оружия.
После опытов А. Л. Лавуазье, проведённых в 1774—1777 гг. и положивших начало опровержению теории флогистона, идеи учёного широко распространились в Европе. Экспериментальной проверкой этих идей занимались не только химики, но и физики. Одним из них был академик Петербургской академии наук Василий Владимирович Петров. Самые знаменитые его эксперименты связаны с построенной в 1802 г. гигантской батареей из 4200 гальванических элементов (см. дополнительный очерк «Огромная наипаче батарея»). Гораздо менее известны химические опыты Петрова. В 1797 г. он обратил внимание на факт, на первый взгляд противоречащий кислородной теории Лавуазье. Некоторые вещества могли гореть не только на воздухе, но и в безвоздушной среде. Это были порох, гремучее золото и гремучее серебро — соли гремучей кислоты HCNO. Сжигая подобные вещества в вакууме с помощью сфокусированного солнечного света, учёный сделал вывод, что в данном случае горение происходит за счёт кислорода, или, как он писал, «кислотворного вещества», входящего в состав указанных соединений.
Труд Петрова «Собрание физико-химических новых опытов и наблюдений» был опубликован в 1801 г. Текст его выдержан в лучших традициях учёных трактатов. Автору присуши постоянные сомнения в правильности сделанных выводов и стремление разрешить эти сомнения на основе беспристрастных экспериментов. Он многократно повторяет одни и те же опыты, чтобы избежать случайных помех, не считает возможным замалчивать «неудобные» результаты опытов и обязательно использует все имеющиеся экспериментальные данные.
«Когда я читал Физикохимические бессмертного Лавуазье сочинения... — пишет Петров, — я иногда был побуждён к принятию антифлогистического учения, а иногда, оставаясь ещё в сомнениях об оном, с возможным вниманием и беспристрастием размышлял, должно ли, или не должно смело последовать оному...
Древние философы относили воздух к числу важнейших стихий, из которых построен мир. Леонардо да Винчи (1452—1519), изучая процессы горения, отмечал, что воздух состоит из различных «частей» (веществ), но только одна из них расходуется при горении. Подобную мысль высказывали и другие учёные XVI—XVIII вв. Однако кислород открыли лишь в 70-х гг. XVIII столетия независимо друг от друга английский химик Джозеф Пристли и его шведский коллега Карл Шееле.
Мышьяк. Его природные соединения необычайно красивы. Это сульфиды — красный реальгар As4S4 (от араб, «рахдж аль гхар» — «пыль пещеры, рудника») и золотисто-жёлтый аурипигмент As2S3, которые упоминаются уже античными авторами. Алхимики считали, что мышьяк является составной частью всех металлов. Особое отношение к мышьяку в Средние века объясняется не только тем, что многие его соединения ядовиты, но также и способностью этого элемента «превращать медь в серебро». Когда в расплавленную медь добавляют мышьяк, она приобретает белый цвет, становясь похожей на серебро. Выделение мышьяка в виде простого вещества традиционно связывают с именем теолога и алхимика XIII в. Альберта Великого. Русское название элемента — это, по-видимому, искажённое «мышиный яд», «мышь-яд». Латинское Arsenicum происходит от греческого наименования сернистых соединений мышьяка. «Арсеникон» по-гречески означает «сильный», «мужественный» — такую дань благоговения воздали древние исключительно ядовитым соединениям мышьяка.
Пожалуй, самое известное применение висмута — легкоплавкие сплавы на его основе. Чаше других используют сплав Вуда, содержащий 50 % висмута, 25 % свинца и по 12,5 % олова и кадмия. Плавится он уже при 69 °С, хотя каждый из исходных металлов имеет значительно более высокую температуру плавления (Bi — 271 °С, Pb — 327 °С, Sn — 232 °С, Cd — 321 °С). Подобные сплавы применяют в качестве легкоплавких припоев, предохранителей в электрической аппаратуре.
Все знают, как трудно свернуть в кольцо или спираль металлическую трубочку с тонкими стенками, не сплющив её. Если же предварительно залить в слегка разогретую трубочку сплав Вуда, то после застывания ей можно без труда придать нужную форму. А затем,
снова разогрев, вылить легкоплавкий состав.
Рассказывают о шутнике, который изготовлял из сплава Вуда чайные ложки. В руках ничего не подозревающих простаков они неожиданно стекали на дно стакана с горячим чаем.
Чтобы зафиксировать ядерные реакции, рождение и гибель элементарных частиц, используют сложные физические приборы, позволяющие увидеть это в особой среде, например в переохлаждённых парах воды или спирта. Пролетающая частица вызывает вдоль своего пути конденсацию охлаждённых паров в виде крошечных капелек тумана. В электрическом или магнитном поле следы заряженных частиц — треки — искривляются. Их можно сфотографировать. Один из таких снимков был сделан в 1952 г. Очень похожая «фотография» была получена в домашних условиях школьником из Красноярска Александром Сироткиным. Вот что рассказал юный химик:
«Фотографию „деления ядра" я сделал дома, без всяких приборов. И каждый желающий может повторить мой опыт. Нужны только порошок сурьмы да пара листов бумаги. Порошок можно приготовить из куска сурьмы, измельчив его в ступке или же разбив молотком, — ведь это вещество хрупкое. В клочок газетной бумаги размером примерно 1,5х2 см надо завернуть немного порошка и туго закрутить наподобие кулька. На пол положите лист белой бумаги. Взяв кулёк пинцетом за свободный конец, поднесите зажжённую спичку к тому месту, где находится сурьма, и не убирайте, пока она не расплавится и не начнёт окисляться, выделяя белый дым. Всё это проделывайте над чистым листом белой бумаги, на который раскалённая сурьма и должна упасть, разбегаясь огненными шариками. При этом на листе останутся следы, похожие на треки заряженных частиц. Огненные шарики сурьмы, скользящие по бумаге на газовой подушке, просто-напросто обугливают её. И пол при этом не портится — следы от горящей сурьмы легко стираются тряпкой. И всё же, конечно, лучше его не пачкать, подложив под лист бумаги фанерку или картон».
(XII в.) открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит гамбургскому алхимику-любителю Хеннигу Бранду (около 1630—1730). В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить её из большого количества мочи, предварительно собранной в солдатских казармах. При нагревании этой жидкости Бранду удалось выделить тяжёлое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
Ортофосфорная кислота является трёхосновной кислотой, средней силы по первой ступени и слабой по второй и третьей.
Всем этим трём анионам (РО43-, НРО42-, Н2РО4-) соответствуют различные соли — кислые, средние или основные.
При смешении растворов хлорида кальция и ортофосфата натрия (среда сильнощелочная в результате гидролиза соли) образуется осадок основного фосфата кальция — минерал апатит:
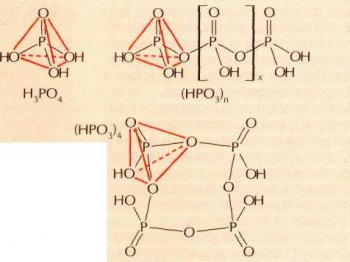
Строение ортофосфорной кислоты и метафосфорных кислот.
Оксид фосфора(IV) и фосфорную кислоту получил и исследовал немецкий химик Андреас Cuгизмунд Маргграф. Оксид фосфора (V) жадно поглощает воду, переходя в метафосфорную кислоту НРО3, — на этом основано его использование в качестве осушителя. Известно несколько метафосфорных кислот с обшей формулой (НРО3)x, где х=4 (тетраметафосфорная кислота), 6 (гексаметафосфорная кислота) или бесконечности (полиметафосфорные кислоты). При кипячении раствора метафосфорных кислот связи между отдельными фосфор-кислородными тетраэдрами разрываются, и метафосфорная кислота переходит в ортофосфорную кислоту H3PO4. В растворе для фосфорных кислот (в противоположность азотной кислоте) проявление окислительных свойств не характерно.