(XII в.) открыл фосфор при перегонке мочи в смеси с глиной, известью и углём. Однако достоверное открытие и описание свойств этого вещества принадлежит гамбургскому алхимику-любителю Хеннигу Бранду (около 1630—1730). В 1669 г. Бранд был занят поиском магической жидкости, с помощью которой можно превращать неблагородные металлы в золото. В одном из экспериментов он пытался получить её из большого количества мочи, предварительно собранной в солдатских казармах. При нагревании этой жидкости Бранду удалось выделить тяжёлое красное масло, которое перегонялось с образованием твёрдого остатка. Нагревая последний без доступа воздуха, он заметил образование белого дыма, оседавшего на стенках сосуда и ярко светившегося в темноте. Бранд и назвал полученное им вещество фосфором, что в переводе с греческого означает «светоносец».
Несколько лет «рецепт приготовления» фосфора хранился в строжайшей тайне и был известен лишь нескольким алхимикам. В 1680 г, это вещество независимо от Бранда выделил Р. Бойль.
В несколько модифицированном виде старинный метод получения фосфора использовали и в XVIII столетии: нагреванию подвергали смесь мочи с оксидом свинца, поваренной солью, поташом и углём. Лишь в 1774 г. К. В. Шееле разработал способ получения фосфора из рога и костей животных.
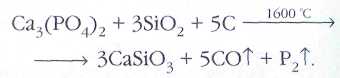
Пары фосфора при этой температуре почти полностью состоят из молекул Р2, которые при охлаждении конденсируются в молекулы Р4.
При конденсации паров образуется белый (жёлтый) фосфор (tпл=44 °С, tкип
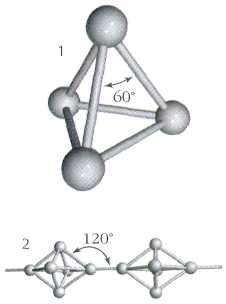
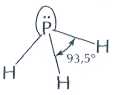
Если белый фосфор нагревать без доступа воздуха, он переходит в красный (впервые его получили лишь в 1847 г.). Название красный фосфор относится сразу к нескольким модификациям, различающимся по плотности и окраске: она колеблется от оранжевой до тёмно-красной и даже фиолетовой. Все разновидности красного фосфора нерастворимы в органических растворителях, по сравнению с белым фосфором они менее реакционноспособны (воспламеняются на воздухе при t>200 °С) и имеют полимерное строение: это тетраэдры Р4, связанные друг с другом в бесконечные цепи. Несколько отличен от них «фиолетовый фосфор», который состоит из группировок Р8 и Р9, уложенных в длинные трубчатые структуры с пятиугольным сечением. При повышенном давлении белый фосфор переходит в чёрный фосфор, построенный из объёмных шестиугольников с атомами фосфора в вершинах, связанных друг с другом в слои. Впервые это превращение (при t=200 °С и р=12 000 атм) осуществил в 1934 г. американский физик Перси Уильямс Бриджмен (1882— 1961). Структура чёрного фосфора напоминает графит, с той лишь разницей, что слои, образованные атомами фосфора, не плоские, а «гофрированные». Чёрный фосфор — это наименее активная модификация фосфора. При нагревании без доступа воздуха он, как и красный, переходит в пар, из которого конденсируется белый фосфор. Белый фосфор очень ядовит: смертельная доза около 0,1 г (примерно такая же и у цианистого калия — 0,12 г). Из-за опасности самовоспламенения на воздухе его хранят под слоем воды. Красный и чёрный фосфор менее ядовиты, так как нелетучи и практически нерастворимы в воде. Белый фосфор уже при комнатной температуре, а остальные модификации — при нагревании вступают в реакцию со многими простыми веществами: галогенами, кислородом, серой, некоторыми металлами. Интересно протекает реакция белого фосфора с раствором щёлочи: Р4+3NaOH+3Н2О=3NaH2PO2+РН3. При этом образуется гипофосфит натрия — соль одноосновной фосфорноватистой кислоты Н3РО2 — и выделяется фосфин РН3 — бесцветный газ с резким запахом, воспламеняющийся на воздухе. Фосфин проявляет донорные свойства в гораздо меньшей степени, чем аммиак его водные растворы имеют нейтральную реакцию среды. При сжигании фосфора на воздухе образуется белый дым, состоящий из мельчайших частиц оксида фосфора(V) Р2О5. Одна из модификаций этого соединения построена из молекул Р4О10, в которых каждый атом фосфора окружён четырьмя атомами кислорода, расположенными в вершинах тетраэдров. Около 80 % от всего производимого белого фосфора идёт на синтез чистой («термической») ортофосфорной кислоты. Она в свою очередь используется для получения полифосфатов натрия (их применяют для снижения жёсткости питьевой воды: эти вещества прочно связывают ионы кальция) и пищевых фосфатов. Оставшаяся часть белого фосфора расходуется на создание дымообразующих веществ, зажигательных смесей, а также переводится в красный фосфор. Красный фосфор находит применение в металлургии, производстве полупроводниковых материалов и ламп накаливания, используется в спичечной промышленности.
Строение фиолетового (1) и чёрного (2, 3 — разные проекции) фосфора.
Строение белого (1) и красного (2) фосфора.
Строение фосфина РН3

Похожие статьи