Мышьяк. Его природные соединения необычайно красивы. Это сульфиды — красный реальгар As4S4 (от араб, «рахдж аль гхар» — «пыль пещеры, рудника») и золотисто-жёлтый аурипигмент As2S3, которые упоминаются уже античными авторами. Алхимики считали, что мышьяк является составной частью всех металлов. Особое отношение к мышьяку в Средние века объясняется не только тем, что многие его соединения ядовиты, но также и способностью этого элемента «превращать медь в серебро». Когда в расплавленную медь добавляют мышьяк, она приобретает белый цвет, становясь похожей на серебро. Выделение мышьяка в виде простого вещества традиционно связывают с именем теолога и алхимика XIII в. Альберта Великого. Русское название элемента — это, по-видимому, искажённое «мышиный яд», «мышь-яд». Латинское Arsenicum происходит от греческого наименования сернистых соединений мышьяка. «Арсеникон» по-гречески означает «сильный», «мужественный» — такую дань благоговения воздали древние исключительно ядовитым соединениям мышьяка.

Название минерала «аурипигмент» As2S3 (лат. auripigmentum — «золотая краска»), равно как и русское его наименование — «жёлтый мышьяк», подчёркивает необыкновенно красивую золотисто-жёлтую окраску. Однако сам минерал едва ли спутаешь с золотом. Это ковалентное соединение со слоистой структурой, и, следовательно, его легко растереть в порошок. Псковские иконописцы часто заменяли золото на иконах аурипигментом.
Как и фосфор, мышьяк существует в виде нескольких аллотропных модификаций, из которых наиболее устойчив серый мышьяк — твёрдое вещество серого цвета с металлическим блеском (tпл=816 °C при р=38,6 атм), построенное наподобие чёрного фосфора.
Когда мышьяк сгорает на воздухе, образуется оксид As2O3, известный ещё алхимикам под названием «белый мышьяк». Это ангидрид слабой мышьяковистой кислоты H3AsO3. Её медная соль (арсенит меди) очень долго использовалась как зелёная краска — зелень Шееле CuHAsO3. В старину белый мышьяк был весьма «популярным» ядом, смертельная доза его для человека составляет 20 — 300 мг. Например, галицкий князь Дмитрий Шемяка, по приказу которого в 1446 г. ослепили великого князя московского Василия II, был отравлен именно соединениями мышьяка. Это доказано химическими методами при изучении останков князя в 80-х гг. XX столетия. Несмотря на ядовитость, белый мышьяк до сих пор применяют в стоматологии. При окислении мышьяка или As2O3 крепкой азотной кислотой образуется мышьяковая кислота H3AsO4, по свойствам близкая к ортофосфорной кислоте.
Некоторые соединения мышьяка находят широкое применение в электронике. Так, германий при введении в него небольшого количества мышьяка становится полупроводником n-типа (с электронной проводимостью). Среди полупроводниковых материалов большое распространение получил арсенид галлия GaAs, изоэлектронный германию (т. е. содержащий такое же количество электронов). Данное вещество образуется, когда галлий сплавляют с мышьяком при высоком давлении. На основе арсенида галлия выполняются многие элементы микросхем, фотодиодов, транзисторов, солнечных батарей.
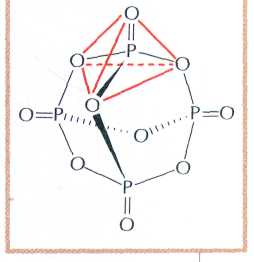
Строение молекулы P4O10.

Добыча аурипигмента. Миниатюра из «Книги о простейших лечебных средствах» Платтеария Маттеуса. Франция. Середина XV в.
Сурьма имеет много имён. Русское «сурьма» происходит от тюркского слова, означающего «грим», «мазь», «притирание». Блестящий чёрный порошок сурьмяного блеска — сульфида сурьмы(Ш) Sb2S3 — уже во II тысячелетии до н. э. служил для подкрашивания ресниц. Латинское название сурьмы (Stibium) впервые встречается у Плиния Старшего.
Добыча сурьмы. Миниатюра из «Книги о простейших лечебных средствах» Платтеария Маттеуса. Франция. Середина XV в.
Оксид Sb2O3 является амфотерным, т. е. реагирует и с щелочами, и SbCl3+H2O=SbOCl¯+2HCl.
Соль калия, антимонила и винной кислоты K(SbO)C4H4O6•Н2О (под названием «рвотный камень») долгое время использовали в медицине.
Высший оксид сурьмы проявляет свойства кислотных оксидов: влажный Sb2O5 окрашивает лакмусовую бумажку в красный цвет. При этом в растворе в незначительной концентрации образуется слабая неустойчивая сурьмяная кислота H[Sb(OH)6], известная главным образом по малорастворимым в воде солям — антимонатам щелочных металлов, например Na[Sb(OH)6].
Химией соединений сурьмы активно занимались алхимики. Впервые сурьму и способ её получения из сурьмяного блеска, а также некоторые её соли (SbCl3 и др.) описал немецкий алхимик Василий Валентин (XV—XVI вв.).
Сростки кристаллов висмута.
Висмут тоже упоминается в трудах европейских алхимиков, хотя вплоть до XVIII в. его, как и сурьму, часто путали со свинцом. Происхождение слова «висмут» недостаточно ясно. По одной из гипотез, оно образовано от искажённых немецких слов wis и mat (weibe Masse), что переводится как «белая масса».
Висмут — блестящий хрупкий тугоплавкий металл (tпл =271 °С, tкип=1560 °С). Оксид Bi2O3 проявляет свойства основного оксида, а вот оксид висмута(V) Bi2O5 является уже кислотным оксидом. Его соли, висмутаты (например, NaBiO3), — сильные окислители.
Оксид висмута(Ш) используют в производстве эмалей и керамических красок. Соли висмута (нитрат висмутила BiONO3•Н2О) находят применение в медицине в качестве вяжущих средств.
Титульный лист книги Василия Валентина «Триумфальная колесница антимония». Издание 1604 г.




Похожие статьи