Селен был открыт в 1817 г. Й. Я. Берцелиусом в отходах сернокислотного производства. Наименование своё, образованное от греческого «селене» — «луна», элемент получил по аналогии с теллуром, который был выделен 40 годами ранее из золотоносной руды и назван в честь «матери Земли» (от лат. tellus — «земля», «планета»).
Селен существует в нескольких аллотропных формах. Наиболее устойчивым является серый селен — твёрдое вещество с металлическим блеском и свойствами полупроводника (tпл=217 °C, tкип=685 °C. Crорая на воздухе, он образует оксид SeO2 — белый порошок, легкорастворимый в воде; его водный раствор — слабая селенистая кислота H2SeO3.
Известна также и селеновая кислота H2SeO4, по свойствам во многом близкая серной кислоте. Однако H7SeO4 — ещё более энергичный окислитель, способный растворять даже золото:
2Au+6H2SeO4 =Au2(SeO4)3+3H2SeO3+3Н2О.
Селеновая кислота не только обугливает многие органические вещества, но и воспламеняет их (даёт вспышку с углеродом).
Селен используется в копировальных аппаратах (ксероксах), а также в полупроводниковых приборах — диодах, фоторезисторах.
В организме человека содержится около 14 мг селена. Он относится к числу важных микроэлементов — стимулирует синтез серосодержащих аминокислот, входит в состав фермента глутатионпероксидазы, предохраняющего гемоглобин крови от окисления пероксидами.
Недостаток селена в организме человека приводит к ослаблению его иммунной защиты (больше всего селена — около 0,2 — 0,3 мг/кг — содержится в мясе и твороге). Однако переизбыток этого элемента тоже вреден: он ведёт к отравлению, одним из симптомов которого является выпадение волос.

Серый селен.
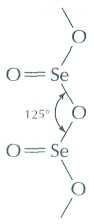
В отличие от оксида серы (IV) SO2, оксид селена(IV) SeO2 (tпл=337 °С) имеет полимерное строение.
Похожие статьи