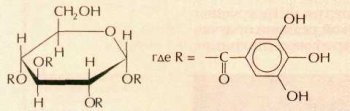Виктор Гриньяр писал о магнийорганических соединениях, что они в руках химика подобны скрипке в руках умелого музыканта. Действительно, использование магнийорганических соединений открывает практически неисчерпаемые возможности органического синтеза. Реактивы Гриньяра взаимодействуют с альдегидами, кетонами, сложными эфирами, нитрилами, азосоединениями и т. д. Спектр получаемых продуктов, безусловно, столь же разнообразен (см. схему).
С реактивами Гриньяра также взаимодействуют и многие неорганические соединения, содержащие кратную связь, — диоксиды углерода, серы, селена, теллура.
В 1855 г. при попытке выделить органический радикал бутил в реакции бутилбромида с натрием Шарль Вюрц вместо бутила получил продукт его «сдваивания» — октан: С4Н9Br ®«С4Н9»+NaBr; 2«С4Н9»®С8Н18.
По одной из современных версий, механизм этой реакции включает в себя образование натрийорганического соединения C4H9Na с его последующим взаимодействием с С4Н9Br.
С 60-х гг. XIX в. благодаря усилиям Франкленда начала стремительно развиваться химия цинкорганических соединений. А в 1899 г. учёный определил условия, при которых в реакции участвуют магнийорганические соединения. Однако все попытки выделить их заканчивались неудачей.
Главная проблема заключалась в том, что их считали подобными цинкорганическим, которые были достаточно хорошо изучены, и пытались получить аналогичными методами. Однако цинкорганические соединения — летучие жидкости, а магнийорганические — твёрдые солеподобные вещества, следовательно, для их получения нужен другой подход. И такой подход был найден уже в 1900 г.,
Элементоорганическая химия строит мост между органической и неорганической химией. По мере развития и роста элементоорганической химии этот мост становится массивом, смешивающим воедино оба материка химии.
А. Н. Несмеянов
В 1823 г. датский фармацевт Вильям Кристофер Цейзе (1789—1847) при кипячении платинохлороводородной кислоты в этиловом спирте впервые выделил комплекс металла с этиленом - K[PtCl3(CH2=CH2)]•Н2О. Результат был столь необычен, что многие химики вообще не поверили в существование подобных соединений, ведь соль Цейзе явно не принадлежала ни к одному из известных в то время классов веществ. Потому-то Юстус Либих и считал результаты Цейзе ошибкой эксперимента. Однако в 1849 г. английский химик Эдуард Франкленд (1825—1899) случайно открыл ещё одно соединение этого типа. Приступая к опытам, учёный рассчитывал получить свободный этил — по аналогии с реакциями активных металлов с солями:
Чувствительность языка неодинакова к различным вкусам. Первое место занимают вещества горькие. Это именно тот случай, когда ложка дёгтя портит бочку мёда. Действительно, вкус хинина или стрихнина, например, отчётливо ощущается, даже если развести их в воде в соотношении 1 : 100 000 и более (примерно чайная ложка вещества в 500 кг воды!).
Впервые хинин был выделен из коры хинного дерева, произрастающего в Южной Америке. Это белое кристаллическое вещество применяется как одно из самых эффективных средств против малярии. В очень малых количествах хинин добавляют к горчащим напиткам типа тоника, хорошо утоляющим жажду. Обнаружить это вещество можно не только по вкусу, но и по яркому нежно-голубому свечению под лучами ультрафиолетовой лампы.
Порошок нестерпимо горького хинина фармацевты обычно заключают в капсулы из желатина. Человек глотает капсулу, не ощущая никакого вкуса; потом в пищеварительном тракте желатин растворяется, и лекарство попадает в кровь. Однако описаны случаи, когда после приёма хинина в капсулах, исключающих непосредственный контакт лекарства с языком, люди жаловались на горький вкус во рту. Вероятно, попав в кровь, хинин возбуждает вкусовые нервы «изнутри языка».
Хинин относится к классу алкалоидов — так называют природные соединения, выделяемые обычно из растений и содержащие в молекуле один или несколько атомов азота. Вообще среди алкалоидов много горьких и очень горьких веществ, например кофеин, никотин, стрихнин. Известно более тысячи алкалоидов, и многие из них не только горькие, но и ядовитые (стрихнин, кураре). Возможно, ощущение их отвратительного вкуса выработалось у человека в процессе эволюции как защитная реакция организма против отравления.
Всем известно, что лучший способ снять усталость после рабочего дня — выпить одну-две чашки крепкого чая или кофе.
В листьях чая и зёрнах кофе содержится от одного до трёх процентов алкалоида кофеина, являющегося производным пурина. При заваривании чая или приготовлении кофе кофеин переходит в раствор. В растениях кофеин образуется по сложной цепочке превращений из пуриновых оснований — аденина и гуанина. В промышленности его выделяют из отходов чайного производства, из несортовых кофейных зёрен, а также получают синтетически.
Кофеин C8H10N4O2 представляет собой бесцветные горькие на вкус шелковистые игольчатые кристаллы (tпл=235 °С), легко растворимые в горячей воде и хлороформе.
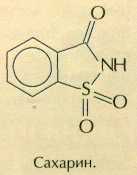
Сахарин — самый давний и наиболее известный пищевой заменитель сахара. Чтобы почувствовать его вкус, достаточно всыпать в железнодорожную цистерну с водой всего лишь ложку этого вещества! Впервые сахарин синтезировали в 1878 г. американские химики Аира Ремсен и Константин Фальберг. А случилось это так. В лаборатории профессора Ремсена работал молодой эмигрант из России Фальберг. Он занимался синтезом некоторых производных толуолсульфамида. Как-то Фальберг сел обедать, не вымыв как следует руки, и почувствовал, что пища подозрительно сладковата. Придя обратно в лабораторию, он начал проверять на вкус все реагенты, с которыми работал. Один из промежуточных продуктов синтеза оказался очень сладким. Вещество назвали сахарином. По своему строению это гетероциклическое соединение — имид орто-сульфобензойной кислоты.
Сахарин не усваивается организмом и в небольших дозах безвреден, однако по вкусу отличается от сахара, так как слегка горчит. Кстати сказать, до синтеза сахарина считалось, что сладкими могут быть только природные соединения, поэтому никому не приходило в голову специально пытаться синтезировать такие вещества в лаборатории.
В 1884 г. другой американский химик, Дж. Берлинерблау, тоже случайно получил ещё одно сладкое вещество — 4-этокси-фенилмоче-вину С2Н5О—C6H4—NH—CO—NH2. Новое соединение было названо дульцином (от лат. dulcis — «сладкий»). Оно оказалось в 200 раз слаще сахара и в течение полувека применялось как подсластитель, пока не было доказано его вредное воздействие на здоровье человека.
В мире органических молекул случаются необычные перестановки атомов, которые практически не изменяют «внешнего» вида молекулы, но приводят к существенным различиям в химических свойствах веществ.
Таковы, например, бензол и его структурный аналог — шестиатомный азотсодержащий гетероцикл пиридин.
Замена одного фрагмента — СН= в бензольном ядре на трёхвалентный атом азота не нарушает ароматичности цикла, так как число p-электронов в общем электронном облаке циклической молекулы при этом не уменьшается. Оно по-прежнему равно 6, и молекула пиридина соответствует «ароматическому» критерию Хюккеля.
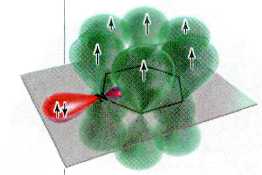
Строение p-системы молекулы пиридина.
В 1492 г. матросы Христофора Колумба, высадившись на острове, названном ими Сан-Сальвадор, увидели, что туземцы свёртывают трубочкой листья каких-то растений, поджигают их и втягивают в себя дым. Траву для курения местные жители называли «табаго», а трубочки — «сигаро». От этих названий и произошли современные слова «табак» и «сигара» («сигарета» — от исп. sigareta — «маленькая сигара»).
Сам Колумб так описал обычай курения листьев туземцами: «Высадившись на берег, мы отправились в глубь острова. Нас встретило множество почти голых людей, которые шли из своих деревень с горящими головешками в руках и травой, дым которой они „пили", т. е. глубоко вдыхали через рот в лёгкие. Некоторые несли одну большую „сигаро", при каждой остановке зажигали её, затем каждый делал из неё три-четыре затяжки, выпуская дым через ноздри».
Американские индейцы курили табак исключительно в ритуальных целях.
Углерод способен образовывать устойчивые кольца не только из собственных атомов; он охотно принимает в «циклическое содружество» и некоторые другие химические элементы — кислород, азот и серу. Органические соединения, в циклических молекулах которых кроме углерода имеются атомы других неметаллов, называют гетероциклическими (от греч. «гетерос» — «разный»). Гетероциклы содержатся в пуриновых и пиримидиновых основаниях, участвующих в построении информационных биомолекул РНК и ДНК, в некоторых аминокислотах, являющихся строительными блоками белков, в большинстве алкалоидов, многих антибиотиках, витаминах и растительных пигментах. Простого перечисления достаточно, чтобы понять, какую огромную роль в жизни растительных и животных организмов играют гетероциклические соединения.
Анилин (фениламин, C6H5NH2) — бесцветная ядовитая жидкость с характерным запахом, малорастворимая в воде (tкип = 184 °С). Так назвал это вещество Ю. Ф. Фрицше, выделивший его в 1840 г. из продуктов взаимодействия краски индиго со щёлочью (от араб. «ан-нил» — «синяя краска», «индиго»). Анилин — простейший представитель ароматических аминов. В соединениях этого класса свободная электронная пара атома азота аминогруппы «затянута» в бензольное ядро. Поэтому по свойствам анилин заметно отличается и от алифатических аминов, и от бензола. Так, по сравнению с аммиаком и алкиламинами (например, метиламином CH3NH2), анилин представляет собой гораздо более слабое основание. Его водные растворы не изменяют окраски лакмуса и фенолфталеина. Однако в присутствии сильных кислот анилин, как и другие амины, образует соли (например, хлорид фениламмония [C6H5NH3]+Cl-).
Одна из основных операций при выработке кожи и меха — дубление. Так принято называть обработку шкур специальными веществами, делающими поверхность материала более прочной и упругой.
Кожа состоит из тонких волокон белка коллагена, образующих своеобразную сетчатую структуру. Эта структура и придаёт коже упругость. В результате дубления между отдельными волокнами коллагена образуются поперечные связи, и возникает более прочная пространственная структура. Дублёная кожа устойчивее к внешним воздействиям и меньше подвержена набуханию.
В качестве дубильных веществ используют органические и неорганические соединения. К органическим относятся таниды, содержащиеся в коре и листьях некоторых деревьев и кустарников, где они образуются из углеводов и фенолов. Больше всего танидов (10,5 %) в коре молодого дуба, из которой делают экстракт, применяемый при дублении
Простейший представитель класса фенолов — соединение, давшее название всему классу, С6Н5ОН. Это бесцветное кристаллическое вещество (tплав=41 °С) с характерным запахом, плохо растворимое в холодной воде. Попав на кожу, фенол вызывает ожоги, поэтому обращаться с ним нужно осторожно.
Источник фенола — каменноугольная смола, из которой он был впервые выделен в 1834 г. В наше время его получают из бензола и пропилена — кумольным способом, разработанным в 1949 г. советским химиком Рудольфом Юрьевичем Удрисом.
По химическим свойствам фенол отличается от спиртов и бензола. Это слабая кислота, и долгое время его называли карболовой кислотой. Фенол обладает бактерицидным действием — он убивает даже самые стойкие бактерии и микроскопические грибки. Поэтому его водный 5-процентный раствор широко применяли для дезинфекции помещений.