Французский учёный Жозеф Луи Гей-Люссак (1778—1850) прославился и как физик, и как химик. Его имя носят газовые законы, которые сыграли большую роль в разработке атомно-молекулярного учения. В 1802 г. Гей-Люссак установил, что объём газа при постоянном давлении увеличивается пропорционально температуре.
Несколько позже он сформулировал ещё один закон: давление газа в замкнутом объёме также пропорционально температуре.
В 1808 г. Гей-Люссак (совместно с немецким естествоиспытателем Александром Гумбольдтом) сформулировал важнейший для развития химии закон объёмных отношений. Согласно ему, реагирующие газы соединяются таким образом, что соотношение между их объёмами, а также объёмом газообразного продукта реакции выражается простыми целыми числами (при условии, что температура и давление остаются постоянными). Например, 2 объёма водорода соединяются с 1 объёмом кислорода, давая 2 объёма водяного пара; 1 объём хлора реагирует с 1 объёмом водорода, что даёт 2 объёма нового газа — хлороводорода; 3 объёма водорода и 1 объём азота образуют 2 объёма аммиака, и т. д. Сейчас мы записали бы стехиометрические уравнения реакций просто и лаконично: 2Н2+О2=2Н2О; Сl2+Н2=2НСl; ЗН2+N2=2NH3. Но в те времена ещё не было чёткого разграничения понятий атома и молекулы, не существовало и современных обозначений химических элементов, формул их соединений.
Гей-Люссак ничего не говорил о том, в виде каких частиц участвуют в реакциях газы. Тогда считали, что все газы состоят из атомов; подобного мнения долго придерживался и один из виднейших учёных XIX в., фактически глава европейской химии Йёнс Якоб Берцелиус. А поскольку размеры атомов у тех или иных элементов неодинаковы, то полагали, что в равных объёмах различных газов может «поместиться» разное число атомов. Такой взгляд противоречил экспериментальным наблюдениям.
Авогадро в 1811 г., — что имеются также очень простые отношения между объёмами газообразных веществ и числом простых и сложных молекул, образующих эти вещества. Первая гипотеза, которая возникает в связи с этим и которая представляется единственно приемлемой, состоит в предположении, что число составных молекул любого газа всегда одно и то же в одном и том же объёме...». «Простыми молекулами» учёный называл атомы, из которых, по его мнению, построены «сложные», или «составные», молекулы газообразных веществ.
Тремя годами позже Авогадро изложил свою теорию ещё более чётко и сформулировал её в виде закона, который носит его имя:
Равные объёмы газообразных веществ при одинаковом давлении и температуре содержат одно и то же число молекул, так что плотность различных газов служит мерой массы их молекул...
Это добавление было очень важным: оно означало, что, измеряя плотность разных газов, можно определять относительные массы молекул, из которых они состоят. Например, если в 1 л водорода содержится столько же молекул, сколько и в 1 л кислорода, то отношение плотностей этих газов равно отношению масс молекул водорода и кислорода. В 1814 г. к тем же выводам пришёл известный французский физик Анд-ре Мари Ампер (1775—1836). Однако считать Ампера соавтором закона Авогадро, как это делали многие химики, вряд ли справедливо.
Во времена Авогадро его гипотезу нельзя было обосновать теоретически. Такая возможность появилась позднее, с развитием молекулярно-кинетической теории газов. Энергия удара молекул о стенки сосуда не зависит от массы молекул, а зависит только от температуры. Это происходит потому, что лёгкие молекулы движутся быстро, тяжёлые — медленно, а кинетическая энергия у них (при данной температуре) одинаковая.
Следовательно, равное число молекул в данном объёме оказывает одинаковое давление, и наоборот: равное давление двух газов свидетельствует об одинаковом числе молекул в них.
Закон Авогадро давал химикам возможность экспериментально устанавливать состав молекул газообразных соединений. Так, из найденного опытным путём соотношения объёмов водорода, кислорода и паров воды (2:1:2) логически можно сделать два вывода. Первый: молекулы исходных газов состоят из двух атомов, а молекула воды — из трёх, и тогда верно уравнение 2Н2+О2=2Н2О. Второй: молекулы водорода одноатомны, а кислорода и воды — двухатомны, и тогда верно уравнение 2Н+О2=2НО с тем же соотношением объёмов. (Кстати, даже через 50 лет после работ Гей-Люссака некоторые учёные продолжали настаивать на том, что формула воды именно НО, а не Н2О.)
Разрешить дилемму удаётся лишь на основании других опытов. Из них следует, например, что равные объёмы водорода и хлора образуют удвоенный объём хлороводорода. Этот факт сразу отвергает предположение об одноатомности водорода: реакция Н+Cl=НСl не даёт удвоенного объёма НСl. Следовательно, молекулы водорода (а также хлора и кислорода) двухатомны, и верно уравнение 2Н2+О2=2Н2О.
Удивительно, что такие простые доводы не могли убедить некоторых химиков в справедливости (и глубине) закона Авогадро. И, к сожалению, его теория несколько десятилетий оставалась практически незамеченной.

Амедео Авогадро.
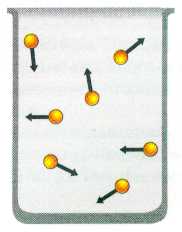
Давление газа обусловлено ударами молекул о стенки сосуда.
ХИМИКИ БЕРУТ ЗАКОН АВОГАДРО НА ВООРУЖЕНИЕ Возродил гипотезу Авогадро и убедил коллег в её справедливости в конце 50-х гг. XIX в. молодой итальянский химик Станислао Канниццаро (1826— 1910). Вслед за своим учителем Рафаэле Пириа (1814—1865) он принял для молекул газообразных элементов правильные (удвоенные) формулы: Н2,
О,, Сl2, Вr2 и т. д. и согласовал таким образом гипотезу Авогадро с экспериментальными данными. «Краеугольный камень современной атомной теории, — писал Канниццаро, — составляет теория Авогадро... Эта теория представляет самый логичный исходный пункт для разъяснения основных идей о молекулах и атомах и для доказательства последних... Вначале казалось, что физические факты были в несогласии с теорией... так что она была оставлена в стороне и скоро забыта; но затем химики самой логикой их исследований и в результате спонтанной эволюции науки, незаметно для них, были приведены к той же теории... Теория, к которой пришли, отправляясь от различных и даже противоположных пунктов, теория, которая позволила предвидеть немало фактов, подтверждённых опытом, должна быть чем-то большим, чем простой научной выдумкой. Она должна быть... самой истиной». После того как гипотеза Авогадро и атомно-молекулярное учение стали общепризнанными, химики получили теоретическое обоснование законов стехиометрии Рихтера и, зная относительные молекулярные массы различных соединений, могли рассчитывать, в каких соотношениях эти соединения будут реагировать.
Например, в соответствии с уравнением реакции С2Н4+С12®С2Н4С12
содержаться одинаковое число молекул. То есть измеряя массу веществ в граммах, химики как бы оперировали молекулами.
Так в химии появилась величина, которую называли грамм-молекулой или молем (слово «моль» придумал в начале XX в. немецкий физикохимик, лауреат Нобелевской премии Вильгельм Оствальд; оно содержит тот же корень, что и слово «молекула» и происходит от лат. moles — «масса»). Ещё недавно в учебниках и справочниках по химии писали: «Грамм-молекула (моль) — такое количество данного вещества, масса которого при выражении в граммах численно равна молекулярной массе этого вещества... Одна грамм-молекула любых индивидуальных веществ содержит одинаковое число молекул». Это определение моля сохранялось в течение почти целого столетия. Был измерен и объём одного моля вещества, находящегося в газообразном состоянии (при условии, что этот газ близок к идеальному): при нормальных условиях (давлении 1 атм=1,013•105 Па и температуре 0°С) он равен 22,4 л. Число же молекул в одном моле стали называть постоянной Авогадро.
В наши дни моль определяется иначе: это количество вещества, содержащего столько же структурных элементов (атомов, молекул, ионов или других частиц), сколько их содержится в 0,012 кг углерода-12. (О том, почему в качестве стандарта был выбран именно 12С, см. статью «В каждой ячейке».) В 1971 г. решением XIV Генеральной конференции по мерам и весам моль был введён в Международную систему единиц (СИ) в качестве седьмой основной единицы. В современном определении постоянная Авогадро (её обычно обозначают NA
Ещё во времена Канниццаро для учёных было очевидно: поскольку атомы и молекулы неописуемо малы, постоянная Авогадро должна быть очень велика. Оперируя мольными количествами веществ, исследователи фактически использовали в неявном виде постоянную Авогадро, однако конкретное её значение никто даже представить не мог. Химиков данная проблема особенно не волновала: ведь и не зная, чему равна эта величина, они прекрасно справлялись со стехиометрическими расчётами.
Вильгельм Оствальд.
ЗА ПОСТОЯННУЮ АВОГАДРО БЕРУТСЯ ФИЗИКИ
Постепенно физики научились определять размеры молекул и значение NA — сначала очень грубо, приблизительно, затем всё точнее. Прежде всего им было понятно, что обе величины связаны друг с другом: чем меньше окажутся атомы и молекулы, тем больше число Авогадро. Впервые размеры атомов оценил австрийский физик Йозеф Лошмидт (1821 — 1895). В 1865 г. он опубликовал работу, где, исходя из молекулярно-кинетической теории газов и экспериментальных данных об увеличении объёма жидкостей при их испарении, рассчитал диаметр молекулы азота. У него получилось 0,969 нм (нанометр — миллиардная часть метра, т.е. 1 нм=10-9 м). Это примерно втрое больше современного значения, но для того времени было хорошим результатом. Во второй статье за подписью Лошмидта, напечатанной в том же году, даётся и число молекул в 1 см3 газа, которое стали называть постоянной Лошмидта (NL). Из неё легко получить значение NA, умножив на мольный объём идеального газа. После Лошмидта значения NL (а также NA) определяли многие учёные. В XIX в. все эти определения были косвенными. В 1890 г. английский физик Джон Уильям Рэлей (1842—1919) и независимо от него немецкий физик Вильгельм Конрад Рентген (1845—1923) провели такой эксперимент: они капали на воду оливковое масло и определяли размер масляного пятна на её поверхности. Зная объём масла V и площадь пятна S, легко рассчитать его толщину d=V/S. Толщина масляной плёнки получилась очень маленькой, всего 0,6— 1 нм, и физики решили, что именно такие размеры имеют молекулы масла. В принципе из этого значения можно получить постоянную Авогадро (хотя Рэлей и Рентген этого не сделали). Оливковое масло — сложная смесь, основной её частью является олеиновая кислота. Моль этой кислоты (182 г) занимает объём 205 см3. Если условно считать молекулы олеиновой кислоты кубиками с ребром 0,8 нм=0,8•10-7 см и, следовательно, объёмом 0,512•10-21 см3, то в объёме 205 см3 таких кубиков поместится 205/(0,512•10-21)=4•1023. Это отличается от современного значения постоянной Авогадро всего в 1,5 раза.
Благодаря развитию атомной физики в XX в. стало возможным измерить постоянную Авогадро «напрямую». В 1908 г. английский физик Эрнест Резерфорд и немецкий физик Ханс Гейгер (1882—1945) определили, что грамм радия испускает за секунду более 34 млрд. a-частиц — ядер атомов гелия.
Захватывая электроны, a-частицы превращаются в обычные атомы гелия, которые постепенно накапливаются в виде газа. Исходя из объёма гелия, выделенного радием за определённый срок, можно рассчитать число молей гелия, а зная скорость испускания a-частиц радием, найти и число атомов гелия в одном моле газа. Этот прямой способ подсчёта числа молекул в моле газа дал результат 6,1•1023.
Более точно постоянную Авогадро можно определить, измеряя рентгенографическим методом межатомные расстояния в кристалле. Современное значение этой постоянной NA=6,0221367•1023.

Похожие статьи