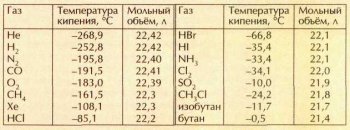
В справочниках можно прочитать, что моль газа при нормальных условиях занимает объём 22,41108 л. Но это справедливо лишь в отношении так называемого идеального газа, для которого принимается, что между молекулами не действуют силы притяжения или отталкивания, а объём самих молекул пренебрежимо мал. Очевидно, что такого газа в природе нет, а реальные газы в большей или меньшей степени отклоняются от законов, писанных для идеального. Между их молекулами всегда существуют силы притяжения, поэтому объём реального газа отличается от объёма идеального. Насколько — зависит от конкретного газа. Вот каковы округлённые мольные объёмы (при нормальных условиях) некоторых газов, рассчитанные из их плотностей:
Тенденция очевидна — чем ближе температура кипения газа к 0 °С, тем сильнее он отличается от идеального. Уравнение для расчёта состояния реальных газов предложил в 1873 г. нидерландский физик Йоханнес Дидерик Ван-дер-Ваальс (1837—1923). В отличие от уравнения идеального газа pV = nRT, в уравнение Ван-дер-Ваальса (р+n2a/V2)(V-nb)=nRT вводятся поправки, которые определяются экспериментом. Первая поправка n2alV учитывает взаимодействие между молекулами реального газа (оно тем меньше, чем больше объём, т. е. чем ниже давление); вторая поправка nb учитывает собственный объём молекул газа.
Поправки становятся существенными при высоких давлениях газов. Так, для азота при давлении порядка 80 атм. расчёт по уравнению идеального и реального газа отличается примерно на 5 %, а с увеличением давления в 5 раз разница достигает уже 100%!
Похожие статьи