Почти в каждой домашней аптечке имеется пузырёк 3-процентного раствора перекиси — пероксида водорода Н2О2. Его используют для дезинфекции ран, остановки кровотечений.
Каков механизм действия препарата? Входящий в состав плазмы крови фермент каталаза (белок, содержащий железо) вызывает каталитическое разложение пероксида:
2Н2О2=2Н2О + О2.
Выделяющийся при этом кислород убивает микроорганизмы и закупоривает сосуды, тем самым способствуя прекращению кровотечения. Интересно, что реакция разложения пероксида ускоряется и при внесении в раствор некоторых соединений переходных металлов, например оксида марганца (IV) MnO2, дихромата калия К2Сr2О7.
С кислородом воздуха водород образует взрывчатую смесь — гремучий газ. Поэтому при работе с водородом необходимо соблюдать особую осторожность. Прежде чем поджечь, его надо предварительно проверить на чистоту. Для этого водородом наполняют небольшую пробирку (так как он легче воздуха, достаточно перевернуть её вверх дном) и отверстием подносят к пламени горелки. Чистый водород сгорает почти бесшумно, а в смеси с воздухом издаёт характерный громкий хлопок. Взрыв гремучего газа в пробирке не представляет опасности для экспериментатора, однако при использовании плоскодонной колбы, стакана или посуды из толстого стекла можно серьёзно пострадать.
Вот какая история произошла с французским химиком, директором Парижского музея науки Пилатром де Розье (1756—1785). Как-то он решил проверить, что будет, если вдохнуть водород; до него никто такого эксперимента не проводил. Не заметив никакого эффекта, учёный решил убедиться, проник ли водород в лёгкие. Он ещё раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в лёгких экспериментатора смешался с воздухом, и произошёл сильный взрыв. «Я думал, что у меня вылетели все зубы вместе с корнями» — так Розье характеризовал испытанные ощущения. Впрочем, он остался очень доволен опытом, который чуть не стоил ему жизни.
Кстати сказать, это был не единственный отчаянно смелый поступок учёного. В ноябре 1783 г. он впервые в мире (в сопровождении армейского офицера маркиза д'Арланда) отважился совершить путешествие на воздушном шаре, поднявшись на высоту 1 км и пролетев за 25 минут около 10 км. И всё же тяга к риску стоила химику жизни. В июне 1785 г. Розье решил перелететь пролив Ла-Манш, но шар загорелся, и учёный, не достигший и 30-летнего возраста, погиб.
Атомарный водород — гораздо более сильный восстановитель, чем обычный, состоящий из молекул Н2. Так нельзя ли получить его нагреванием молекулярного водорода? Оказывается, распад молекул водорода на атомы (термическая диссоциация) начинается лишь при температурах порядка 2000 °С — настолько прочной является молекула Н2. Работать с этим газом при таких температурах в лабораторных условиях практически невозможно. Однако уже давно было замечено, что водород, выделяющийся при разложении водой амальгамы натрия, а также при взаимодействии активных металлов (в частности, цинка) с кислотами, по восстановительной способности превосходит молекулярный. Даже при комнатной температуре он легко восстанавливает соли многих переходных металлов до низших степеней окисления, например хлорид хрома(III) до хлорида хрома(II):
2CrCI3+2Zn+2HCl=2CrCl2+2ZnCl2+Н2.
Если же пропускать через раствор ток водорода из баллона или из аппарата Киппа, то восстановление не протекает. Это объясняется тем, что газ, непосредственно образующийся в ходе реакции, содержит небольшое количество атомарного водорода. Именно он первоначально выделяется на поверхности цинка, и затем атомы тут же, в растворе, рекомбинируют в молекулы: Zn+2Н+=Zn2++2[Н], 2[Н]=Н2.
Такой активный водород называют водородом в момент выделения (лат. in statu nascendi).
(1834—1907)
«Твой папа вот какой: он давно ВСЁ знает, что бывает на свете. Во всё проник. Не укрывается от него ничего. Его знание самое полное. Оно происходит от гениальности, у простых людей такого не бывает», — прочла невеста Александра Блока Любовь Менделеева в его письме от 15 мая 1903 г. «Из всех признаков, отличающих гениальность и её проявление, два, кажется, являются наиболее показательными: это, во-первых, способность охватывать и объединять широкие области знания и, во-вторых, способность к резким скачкам мысли, к неожиданному сближению фактов и понятий, которые для обыкновенного смертного кажутся далеко стоящими друг от друга и ничем не связанными... Эти черты мы как раз и находим у Менделеева» — так писал Лев Александрович Чугаев в начале 20-х гг. XX в.
Принято считать, что периодический закон был открыт Дмитрием Ивановичем Менделеевым 1 марта (17 февраля по старому стилю) 1869 г. Эта дата стала привычной. А в действительности тогда имело место другое событие.
Тридцатилетний профессор Санкт-Петербургского университета к вечеру этого дня завершил разработку таблицы «Опыт системы элементов, основанной на их атомном весе и химическом сходстве».
Этот небольшой листок обычной писчей бумаги относится к числу наиболее ценных документов в истории человечества. Ныне он хранится в Музее-архиве Д. И. Менделеева при Санкт-Петербургском университете. Учёный отпечатал в типографии оттиски «Опыта системы...» с заглавиями на русском и французском языках и разослал их своим отечественным и зарубежным коллегам. Внизу оттиска на французском языке стояла дата по европейскому календарю: «1.Ш. 69». Вот почему, вероятно, с ней и стали связывать открытие периодического закона.
Не зная состава различных веществ, алхимики давали им произвольные названия, нередко очень длинные, неудобные для произношения и трудно запоминаемые. Одно и то же вещество могло иметь несколько имён. Например, к концу XVIII в. для сульфата меди существовало четыре названия, для карбоната меди — десять, для углекислого газа — двенадцать.
Некоторые названия химики ещё помнят, другие канули в Лету, и даже не всякий специалист по истории науки скажет, что такое «пригорело-древесная соль» (а это ацетат кальция, извлекаемый из продуктов сухой перегонки древесины) или «философская шерсть» (оксид цинка, который алхимики получали в виде рыхлого
Роль центрального атома в комплексе способен играть любой элемент. Чаще всего это переходные металлы, степень окисления которых может быть различной, даже отрицательной. Так, например, хром проявляет все степени окисления от —2 до +6: Na2[Cr(CO)5], Na2[Cr2(CO)10], Cr(CO)6, K3[Cr(CN)4], [Cr(NH3)6]Cl2, [Cr(H2O)6]Cl3, K2[CrF6], K3[СrО4], K2[СrО4].
Неметаллы, выступающие в качестве центральных атомов, тоже могут
иметь разную степень окисления. Так, кремний(IV) образует фторосиликат K2[SiF6]; хлор(0) — гидрат [Сl2•(Н2О)б], полученный ещё Фарадеем; иод, помещённый в раствор иодида калия, — комплекс К[I(I2)3], в котором центральный атом имеет степень окисления -1.
В качестве нейтральных лигандов чаще всего выступают СО, Н2О и NH3 (они входят в состав карбонилов, аквакомплексов и аммиакатов соответственно). Возможны и смешанно-лигандные комплексы, например [Cu(NH3)4(H2O)2]2+. Известно множество незаряженных органических лигандов: амины RNH2, фосфины R3P, ароматические соединения (бензол, пиридин) и т. д. Чаще же встречаются заряженные лиганды: галогениданионы, ОН-, CN-, NO2-, ONO- и т. д.
Такой «общей руководящей идеей» стала разработанная к 1893 г. швейцарским химиком Альфредом Вернером теория строения комплексных (или координационных) соединений.
Вернер разделил все неорганические вещества на так называемые соединения первого и высшего порядка. К соединениям первого порядка он отнёс главным образом достаточно простые по своей структуре вещества (Н2О, NaCl, PCl3). Соединениями высшего порядка учёный предложил считать продукты взаимодействия между собой соединений первого порядка — кристаллогидраты, аммиакаты, полисульфиды, двойные соли, а также комплексные соединения.
Комплексное соединение, по Вернеру, должно иметь в своей структуре центральный атом (ион), который равномерно окружён различными ионами или нейтральными молекулами, позднее их назвали лигандами (от лат. ligare — «связывать»). Число донорных атомов лигандов, непосредственно связанных с центральным атомом, называется его координационным числом.
В XIX в. в химии было накоплено большое число фактов, необъяснимых с точки зрения существовавшей тогда теории валентности. Многие вещества, в которых элементы, казалось бы, уже полностью использовали свои валентности, сохраняют способность к дальнейшему присоединению различных ионов и молекул. При этом новые, «незаконные» (с точки зрения теории) связи оказываются не менее прочными, чем «обычные» валентные связи. Некоторые из вновь открытых соединений были названы двойными солями (например, 3KF•AlF3), другие — аммиакатами (CuSO4•4NH3 третьи — кристаллогидратами (CuСl2•6Н2О) и т. д.
Необычность поведения подобных веществ можно продемонстрировать на примере соединений «четырёхвалентной» платины: PtCl4•2NH3, PtCl4•4NH3, PtCl4•6NH3 и PtCl4•2KCl. Несмотря на внешнее сходство, они резко различаются по свойствам. Так, первое из них в растворе практически не распадается на ионы (раствор не проводит электрический ток). Отсутствие хлорид-ионов подтверждает и качественная реакция: при взаимодействии раствора с нитратом серебра осадка AgCl не выпадает.
В начале XVIII в. красильный мастер Дисбах в Берлине приобрёл у торговца необычный поташ (карбонат калия), растворы которого с солями железа давали синее окрашивание. Оказалось, что поташ был ранее прокалён с бычьей кровью. Так открыли новую краску, названную берлинской лазурью. Но лишь гораздо позднее стало понятно, какие же химические процессы приводят к её образованию. Животные остатки, в том числе и кровь, содержат азот и серу. Карбонат калия прокаливали с сухой кровью в больших чугунных сосудах, в которые специально добавляли железные опилки или стружки. В этих условиях карбонат частично превращается в цианид KCN, а сера даёт с железом сульфид FeS. При обработке смеси горячей водой идёт реакция 6KCN + + FeS=K4[Fe(CN)6]+K2S. Её продукты — сульфид калия и соединение, которое в своё время назвали жёлтой кровяной солью (химическое название — гексацианоферрат(П) калия). А слово «цианид» происходит от греческого «кианос» — лазурный.
При взаимодействии жёлтой кровяной соли с солями железа(III) и образуется берлинская лазурь. Состав растворимой формы краски отвечает формуле K[Fe3+Fe2+(CN)6], а нерастворимой — Fe4[Fe(CN)6]3.
С—Н-кислотами называют органические вещества, в которых атомы водорода, связанные с атомом углерода, способны замешаться на металл. Например, заметные «кислотные» свойства проявляют углеводороды с тройной связью — ацетилен (С2Н2) и его производные. Так, ацетилен взаимодействует с металлическим натрием с образованием белого порошка аиетиленида натрия:
2СН=СН+2Na®2Н—СºС—Na+Н2.
Ещё более сильной С—Н-кислотой является трифенилметан (С6Н5)3СН — он реагирует даже с водным раствором щёлочи. Самая сильная из известных С—Н-кислот — цианпроизводное фуллерена: это примерно в 100 раз более сильная кислота, чем уксусная.
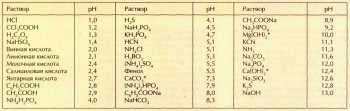
Интересно сравнить кислотность (щёлочность) растворов различных кислот, оснований и солей. Значение рН зависит от концентрации. Поэтому в таблице приведены значения рН водных растворов при концентрации 0,1 моль/л. Для малорастворимых соединений, отмеченных звёздочкой, указаны рН насыщенных растворов. Получается, что если выпить концентрированный лимонный сок, кислотность желудочного сока... понизится! Действительно, раствор лимонной кислоты лишь разбавит более сильную соляную кислоту, содержащуюся в желудочном соке.