Такой «общей руководящей идеей» стала разработанная к 1893 г. швейцарским химиком Альфредом Вернером теория строения комплексных (или координационных) соединений.
Вернер разделил все неорганические вещества на так называемые соединения первого и высшего порядка. К соединениям первого порядка он отнёс главным образом достаточно простые по своей структуре вещества (Н2О, NaCl, PCl3). Соединениями высшего порядка учёный предложил считать продукты взаимодействия между собой соединений первого порядка — кристаллогидраты, аммиакаты, полисульфиды, двойные соли, а также комплексные соединения.
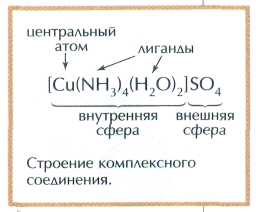
Комплексное соединение, по Вернеру, должно иметь в своей структуре центральный атом (ион), который равномерно окружён различными ионами или нейтральными молекулами, позднее их назвали лигандами (от лат. ligare — «связывать»). Число донорных атомов лигандов, непосредственно связанных с центральным атомом, называется его координационным числом.
Вернер предложил в каждом комплексе различать две координационные сферы: внутреннюю и внешнюю. При записи состава комплексных соединений принято центральный атом вместе со всеми ионами и молекулами, входящими во внутреннюю сферу, заключать в квадратные скобки. Вне скобок остаются лишь внешнесферные ионы, нейтрализующие за-
ряд комплексного иона; в ряде комплексов внешняя сфера может и отсутствовать.
Именно внешние ионы при растворении комплексного соединения в воде легко отщепляются и находятся в растворе самостоятельно, обусловливая (совместно с комплексным ионом) его электропроводность. Лиганды внутренней координационной сферы связаны с центральным атомом настолько прочно, что, по меткому выражению Вернера, словно бы «исчезают» внутри комплекса, никак себя не проявляя ни в аналитических реакциях, ни в электропроводности раствора. Именно поэтому комплексными Вернер назвал соединения, устойчивые в растворах и не проявляющие свойств исходных для них соединений первого порядка. Например, ионы хлора не осаждаются нитратом серебра, а аммиак не пахнет.
Теперь можно объяснить странные свойства четырёх рассмотренных соединений платины, которые ставили в тупик многих химиков XIX столетия. В первом комплексе [PtCl4(NH3)2] нет внешних ионов, поэтому его раствор не проводит ток. Во втором комплексе два иона хлора находятся во внутренней сфере, а два — во внешней, так что в растворе соединение даёт три иона: [PtCl2(NH3)4]Cl2=[PtCl2(NH3)4]2++2Cl-. В третьем комплексе все ионы хлора находятся во внешней сфере, и потому в растворе имеется уже пять ионов: [Pt(NH3)6]Cl4=[Pt(NH3)4]4++4Cl-. Наконец, последнее соединение K2[PtCl6], которое ток проводит, но свой хлор «прячет», в растворе существует в виде ионов К+ и [PtCl6]2-.
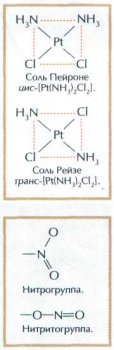
Очень важно, что Вернер рассмотрел и пространственное строение комплексных соединений. Это позволило ему, в частности, объяснить совершенно непонятные прежде случаи изомерии — когда соединения одинакового состава имеют разные свойства. Так, для комплексов с координационным числом 4 он предложил плоскую квадратную структуру. Лиганды могут располагаться в вершинах квадрата разными способами.

Альфред Вернер.

Образование тетрахлорокупрата натрия Na2[CuCl4] при добавлении поваренной соли к раствору медного купороса.
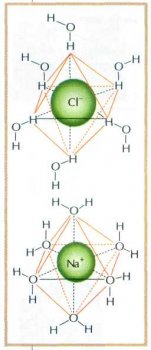
Строение гидратных оболочек ионов в водных растворах.
Например, соль Пейроне, по Вернеру, имеет цис-строение (одинаковые лиганды — соседи), а соль Рейзе — транс-строение (соседствуют разные лиганды).
Второе наиболее распространённое координационное число — 6: лиганды располагаются в вершинах октаэдра. И в этом случае Вернер объяснил различные свойства комплексов их пространственным строением. Например, комплексному катиону [Co(NH3)4(NO2)]+ (степень окисления кобальта +3) красно-жёлтого цвета учёный приписал транс-строение (группы NO2 находятся в противоположных вершинах октаэдра), а аналогичному по составу комплексу жёлто-коричневого цвета — цис-строение (те же группы расположены в соседних вершинах).
В дальнейшем Вернер продолжал совершенствовать свою теорию. Так, он признал, что между главной и побочной валентностями фактически нет различий: все связи между центральным атомом и лигандами равноценны. Однако объяснить, например, каким образом атом никеля может образовать четыре одинаковых связи в комплексном карбониле [Ni(CO)4], во времена Альфреда Вернера было невозможно. Для этого потребовались многочисленные эксперименты и новые теоретические работы, приведшие к современному пониманию природы химической связи (см. статью «Химическая связь»).
Похожие статьи