Принято считать, что периодический закон был открыт Дмитрием Ивановичем Менделеевым 1 марта (17 февраля по старому стилю) 1869 г. Эта дата стала привычной. А в действительности тогда имело место другое событие.
Тридцатилетний профессор Санкт-Петербургского университета к вечеру этого дня завершил разработку таблицы «Опыт системы элементов, основанной на их атомном весе и химическом сходстве».
Этот небольшой листок обычной писчей бумаги относится к числу наиболее ценных документов в истории человечества. Ныне он хранится в Музее-архиве Д. И. Менделеева при Санкт-Петербургском университете. Учёный отпечатал в типографии оттиски «Опыта системы...» с заглавиями на русском и французском языках и разослал их своим отечественным и зарубежным коллегам. Внизу оттиска на французском языке стояла дата по европейскому календарю: «1.Ш. 69». Вот почему, вероятно, с ней и стали связывать открытие периодического закона.
«Опыт системы...» — ещё прообраз будущей естественной системы элементов. Только спустя два года она приобрела законченный вид.
Автограф полной таблицы элементов Д. И. Менделеева, переписанной набело для отправки в типографию 17 февраля 1869 г.
Листок с «Опытом системы элементов» Д. И. Менделеева, отпечатанный на французском языке для рассылки иностранным учёным.
Но ни о какой формулировке закона 1 марта 1869 г. не было и речи. Лишь в статье «Соотношение свойств с атомным весом элементов», написанной спустя четыре дня, Менделеев делает вывод: «Элементы, расположенные по величине их атомного веса, представляют явственную периодичность свойств».
Два с лишним года учёный посвятит созданию основ учения о периодичности. Он введёт представление о периодах — малых и больших — и о группах системы элементов. Назовёт её периодической. И даст, наконец, чёткую формулировку закона:
Измеримые физические и химические свойства элементов стоят в периодической зависимости от атомных весов элементов.
Опираясь на систему, Менделеев совершит то, что впоследствии философы и историки науки назовут научным подвигом: предскажет существование и свойства нескольких, неизвестных ещё элементов — будущих галлия, скандия и германия. Так в химии начнётся эпоха научного прогнозирования.
Закон и система далеко не сразу получили признание научного сообщества, а только после того как были открыты три предвиденных элемента. Но оставалось немало нерешённых проблем. Да и новые достижения науки заставляли усомниться: а так ли всё гладко в таблице Менделеева?
Серьёзные трудности преподнесло ей открытие благородных газов, казалось бы, неспособных вступать в химические реакции, и множества (более 30) так называемых радиоэлементов, для которых в системе не хватало вакантных мест. (Впоследствии выяснилось, что это изотопы ограниченного числа элементов: радия, тория, свинца, висмута и др.) Было неизвестно, существуют ли в природе элементы легче водорода и тяжелее урана. Кроме того, царила неразбериха в области редкоземельных элементов: никто не мог объяснить, почему они так похожи друг на друга и сколько же их всего — этих химических близнецов?
Кабинет
Д. И. Менделеева.
А главное, загадку представляли причины периодического изменения свойств элементов. После создания модели атома Резерфорда — Бора (1911 — 1913 гг.) было доказано: свойства элементов периодически изменяются по мере роста заряда атомного ядра (Z), численно равного порядковому номеру соответствующего элемента. Это единственный случай, когда фундаментальный закон природы существенно изменил свою формулировку. Теперь она звучит так:
Свойства элементов и образуемых ими соединений находятся в периодической зависимости от зарядов ядер их атомов.
Выяснилось, сколько элементов должно располагаться в промежутке между водородом и ураном — четко определёнными нижней и верхней границами системы — и сколько ещё остаётся не открытыми. Наконец, была разработана теория периодической системы.
С тех пор сколь либо принципиальных изменений таблица Менделеева не претерпевала.
Титульный лист первого издания книги А. И. Менделеева «Основы химии».
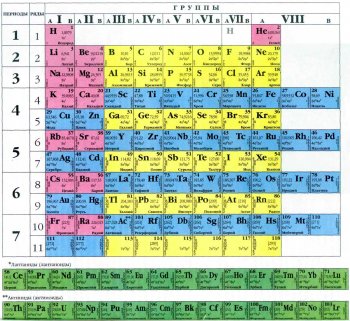
Пробовали подсчитать, сколько вариантов графического изображения периодической системы предлагалось разными учёными. Оказалось, больше 500. Причём 4/5 — это таблицы, а остальное — геометрические фигуры, математические кривые и т. п. Во многих случаях авторами двигало стремление внести некоторые усовершенствования в систему, но нередко новаторство оборачивалось оригинальничанием. В итоге практическое применение нашли четыре вида таблиц: короткая, полудлинная, длинная и лестничная (пирамидальная). Каждая имеет свои достоинства, и едва ли следует обсуждать, какая из них предпочтительней. Мы будем использовать короткую форму.
Главные структурные фрагменты периодической системы — периоды
и группы элементов. В шести периодах все клетки заполнены, седьмой ещё не завершён. Группы подразделяются на главные (А) и побочные (В). Элементы первых трёх (малых, по терминологии Менделеева) периодов входят исключительно в главные подгруппы. Водород в силу уникальности своих свойств не имеет определённого «пристанища», а потому его символ фигурирует дважды — в IA-подгруппе и VIIA-подгруппе. Все периоды, кроме первого, начинаются щелочными металлами и заканчиваются благородными газами. Эти истины составляют, так сказать, «азбуку» таблицы Менделеева.
равняется удвоенному квадрату натурального числа:
Двойка — первое среди простых чисел — оказывается своеобразным «метрономом», задающим определённый ритм построению периодов.
Согласно разработанной в 20-х гг. XX в. теории периодической системы, в атомах существуют оболочки и подоболочки, содержащие электроны, максимально возможное количество которых выражается формулой 2n2
(n — так называемое главное квантовое число, номер оболочки, соответствующий номеру периода). Оболочки (уровни) иногда обозначают латинскими буквами К, L, M, N, О, Р, Q. Они способны вместить соответственно 2, 8, 18, 32... электрона. Каждая оболочка состоит из нескольких подоболочек (подуровней), которые обозначаются s, р, d, f, g... Число подоболочек совпадает с номером оболочки. Максимальные количества электронов на s-,p-, f-подуровнях равны 2, 6, 10, 14... и определяются по формуле 2(2l- 1), где l — орбитальное квантовое число (для s-подоболочки l=1, для p — 2, для d — 3 и т. д.).
У каждого следующего элемента количество электронов увеличивается на один. А поскольку в каждом периоде у атомов добавляется новая
электронная оболочка, самой простой схемой построения системы представляется такая, где на протяжении периода оболочка равномерно заполняется до максимальной ёмкости.
Это и наблюдается в первом и втором периодах. К началу третьего периода К- и L-уровни (n=1 и n=2) оказываются завершены.
Следуя этой логике, можно ожидать окончательного заполнения M-оболочки (n = 3, 18 электронов) у элементов третьего периода. Но элементов в этом периоде только восемь. Поэтому все десять вакантных мест d-подуровня пустуют. В четвёртом периоде (n=4) у калия и кальция начинается заполнение s-подоболочки четвёртого, N-уровня, а вот последующие десять элементов (от скандия до цинка) завершают построение d-подоболочки предыдущего, третьего уровня (n=3). Последние шесть элементов периода доводят р-подуровень N-уровня до завершённого вида.
Однако на этом уровне остаются ещё две подоболочки — d и f . Заполнение первой из них состоится в пятом, а второй — в шестом периоде.
Заселение электронных подуровней в пятом периоде происходит аналогично четвёртому: d- и f-подоболочки ожидают своей очереди и будут застраиваться в последующих периодах.
Шестой период знаменателен тем, что в нём начинается насыщение f-подоболочки N-уровня. Третий по счёту элемент периода — лантан — получает электрон на d-подоболочку О-оболочки (n=5), а затем у элементов с 58-го по 71-й (церий — лютеций) заполняется f-подуровень четвёртого, N-уровня. Это семейство из 14 элементов (по числу f-электронов) получило название «лантаниды», т. е. «следующие за лантаном» (подробнее см. статью «Многодетное семейство»). Начиная с гафния, традиционная схема повторяется: d-подуровень Р-уровня (n=6) постепенно заселяется электронами, и в последних шести клетках шестого периода достраивается 6p-подоболочка.
В седьмом, неоконченном периоде семейство элементов, у которых происходит заполнение f-подоболочки P-уровня, следует за актинием и носит название «актиниды».
Общую последовательность формирования электронных конфигураций атомов в периодах по мере увеличения Z можно записать в виде: 1s®2s®2p®3s®3p®4s®3d®4p®5s® ®4d®5p®6s®5d, 4f®6p®7s®6d, 5f®7p.
Эта схема получила обоснование в рамках методов квантовой механики. В соответствии с её представлениями на смену оболочкам и подоболочкам пришли понятия «энергетический уровень» и «подуровень». Однако и прежние термины продолжают использоваться для объяснения явления периодичности.
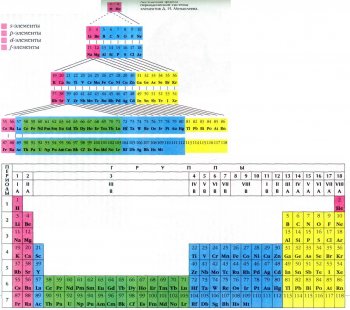
Таким образом, начиная с четвёртого периода, в атомах происходит «ступенчатое» заполнение электронных оболочек и подоболочек В зависимости от того, какая именно под-оболочка заполняется у данного элемента, его относят к s-, р-, d- или f-элементам. В приведённых таблицах соответствующие им клетки окрашены в разные цвета: красный (s), жёлтый (р), синий (d) и зелёный (f).
Великое множество раз воздавали хвалу периодической системе химики и физики, историки науки и философы. «Вероятно, это самый компактный и полный значения сгусток знания, когда-либо изобретённый человеком», — сказал знаменитый американский астроном Харлоу Шепли (1885—1972). Не преувеличивал ли её значение человек, далёкий от химических реалий? Ни в коем случае. Разве что прилагательное «изобретённый» выбрано не очень удачно. Периодическую систему нельзя было «изобрести».
Она является уникальным «банком данных», поскольку содержит богатейшую информацию о свойствах химических элементов, формах их соединений, закономерностях построения электронных конфигураций атомов. Система — это графический (табличный) «образ» периодического закона, не имеющего количественного выражения в виде какой-либо математической формулы или уравнения.
Всего в семи периодах таблицы 118 клеток. Но только в 109 стоят символы элементов и записаны их названия.
Химические элементы распространены в природе весьма неравномерно. Более 99% от массы земной коры составляют всего девять элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний и титан). Все они расположены в верхней части периодической системы. Здесь же находятся элементы-органогены — углерод, водород, азот, кислород.
В свободном виде подавляющее большинство элементов — твёрдые при комнатной температуре вещества. Жидкими являются бром и ртуть, газообразными — водород, азот, кислород, фтор, хлор и благородные газы.
Издавна принято подразделять элементы на металлы и неметаллы, хотя резкой границы между ними провести нельзя. Металлами являются все s-элементы (кроме водорода и гелия), d- и f-элементы. Среди р-элементов чётко выраженных металлов — десять, остальные — неметаллы (к последним принадлежат и 1s-элементы — водород и гелий).
В главных подгруппах содержатся исключительно s- и p-элементы, в побочных — d-элементы. У элементов главных подгрупп заполняется внешняя электронная оболочка, у элементов побочных — предшествующие. Проблема размещения f-элементов (лантанидов и актинидов) решается по-разному в зависимости от формы таблицы Менделеева. Лантаниды по своим свойствам соответствуют IIIB-подгруппе. К ней «приписываются» и актиниды, хотя их химия отличается гораздо большим разнообразием.
Особенности изменения свойств элементов в подгруппах описаны в соответствующих статьях настоящего тома. В малых (первый — третий) и больших (четвёртый — седьмой) периодах с ростом Z свойства изменяются по-разному. Первый содержит лишь два неметалла — Н и Не. Завершённая K-оболочка у гелия весьма прочна, чем и объясняется его полная химическая инертность. Во втором (Li — Ne) и третьем (Na — Ar) периодах наблюдается резко выраженное ослабление металлических свойств и нарастание неметаллических. Устойчивые восьмиэлектронные внешние оболочки Ne и Ar также обусловливают неспособность этих элементов образовывать химические соединения. В четвёртом (К — Kr) и пятом (Rb — Xe) s- и р-элементы разделены «вставками» из 10 переходных металлов, d-элементов.
У элементов больших периодов смена металлических свойств неметаллическими происходит более плавно. В атомах тяжёлых благородных газов s- и р-электроны внешнего слоя способны переходить на вакантные d-орбитали, поэтому удалось получить немало соединений этих элементов, главным образом, ксенона. В шестом периоде (Cs — Rn) к неметаллам определённо относится только радон, тогда как у астата металлические свойства проявляются уже довольно отчётливо. Наконец, в седьмом периоде (Fr — 118) лишь завершающий элемент, по-видимому, также должен бы оказаться единственным неметаллом. Таким образом, для элементов этих двух периодов металлическое состояние становится существенно преобладающим.
Все химические элементы произошли в результате космических процессов ядерного синтеза задолго до того, как образовалась Солнечная система. Существующие на Земле элементы различаются по своему происхождению. Те, что имеют стабильные или только радиоактивные, но долгоживущие изотопы (торий и уран), можно назвать первичными. Естественные радиоактивные элементы, входящие в радиоактивные «семейства», являются вторичными. Периоды полураспада их изотопов гораздо меньше возраста нашей планеты; поэтому их первоначальные «запасы» уже давным-давно исчезли. Теперь эти элементы постоянно образуются как продукты последовательных радиоактивных распадов урана и тория. Периодическая система стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие «химический элемент» и были уточнены представления о простых веществах и соединениях.





Похожие статьи