Наша планета окружена атмосферой — воздушной оболочкой, простирающейся от поверхности Земли более чем на полторы тысячи километров. Масса этого воздушного океана внушает уважение — 5•1015 т! Воздух представляет собой сложный, многокомпонентный газовый «коктейль», который помимо основных составляющих — азота и кислорода — включает аргон, углекислый газ, водяные пары, мельчайшие твёрдые частицы (пыль), капельки воды, а также незначительные примеси многих других веществ (SO2, CH4, NH3, СО, HF, H2, H2S и т. д.).
Важнейшей частью воздуха является кислород, необходимый для дыхания как животным, так и растениям.
Владимир Иванович Вернадский.
Земля — это очень древний и мощный химический реактор. С момента её рождения в недрах планеты, на её поверхности и в воздушной оболочке протекало и по сей день протекает бесчисленное множество химических процессов. Какие-то из них идут быстро, другие длятся миллионы лет. Именно эти реакции и сформировали облик нашей планеты, сделали возможным появление на ней жизни. Химия Земли резко отличается от «пробирочной», лабораторной химии. Отличие первое: в природе многие химические процессы (например, выщелачивание гранитов) идут крайне медленно. Если бы исследователь захотел провести такую реакцию в пробирке, он не дожил бы до конца эксперимента. И даже если бы он завещал потомкам следить за ходом реакции, те тоже вряд ли увидели бы её окончание: стекло, из которого сделана пробирка, разрушится раньше.
В любой химической лаборатории можно увидеть разнообразные плакаты, инструкции, памятки по технике безопасности. Это не только тривиальные таблички типа «Уходя, гасите свет». Немало специфических призывов, скажем: «Водой не гасить!» (например, если в помещении работают со щелочными металлами); есть и узкоспециальные: «Перед включением лампы пусти воду!» (водопроводная вода охлаждает мощный источник света для фотохимических экспериментов — ртутную лампу высокого давления, которая от сильного нагрева может взорваться).
Строгое соблюдение правил помогает сберечь ценное оборудование. В некоторых вузах со студентов взыскивают стоимость разбитых или испорченных по небрежности приборов. Как правило, штрафы устанавливает руководство лаборатории или учебного заведения. Но были и исключения...
Ещё недавно посуда, снабжённая шлифом, была редкостью. Для соединения элементов установок применяли резиновые пробки, которые в органических жидкостях разбухают и не выдерживают сильного нагревания. Поэтому различные стеклянные части приборов просто припаивали друг к другу при помощи паяльной горелки. Великий Берцелиус, сам сконструировавший многочисленные приборы из стекла, считал, что каждый химик должен уметь обращаться со стеклом и стеклодувной горелкой.
Сейчас химики при изготовлении лабораторного оборудования применяют принцип модульности, когда сложную конструкцию монтируют из легкостыкуемых частей — модулей. Практически все приборы сегодня собирают из простых элементов, как в детском конструкторе, а после использования разбирают.
Современная промышленность выпускает готовые приборы, которые также можно собрать и из частей. Это, например, прибор для вакуумной перегонки, обычно называемый химиками перегонкой Клайзена. Раньше такое название носила колба, похожая на колбу Вюрца, но с двумя шейками, одна из которых использовалась для термометра (как в колбе Вюрца), а другая — для капилляра. Через него пропускали
сквозь жидкость пузырьки воздуха или инертного газа, чтобы кипение в вакууме шло равномерно. Это устройство позволяет не применять «кипелки». Потом стали припаивать к колбе Клайзена холодильник Либиха, а иногда и аллонж. Сейчас вместо колбы Клайзена применяют обычную круглодонную колбу, в которую вставляют насадку (насадку Клайзена), а уже к ней присоединяют холодильник. Вместо аллонжа для вакуумной перегонки используют устройство под названием «паук». С его помощью можно собирать перегоняемые жидкости в разные приёмные колбы, удобно сменяя один приёмник другим поворотом паука и не снимая вакуума.
Пожалуй, никто не сделал для экспериментальной химии больше, чем Роберт Вильгельм Бунзен (1811 —1899). Великий немецкий химик-экспериментатор родился в семье профессора университета города Геттингена. Изучая геологию и знакомясь с химическими и металлургическими предприятиями, он много путешествовал. Его научная деятельность ознаменована различными изобретениями. Вот лишь важнейшие из них. Именно Бунзен в 1841 г. придумал угольно-цинковый гальванический элемент, который с небольшими изменениями используется в бытовых батарейках. В 1857 г. он изобрёл газовую горелку, перевернувшую всю химическую практику и названную в его честь. В 1868 г. учёный сконструировал водоструйный насос, позволивший пользоваться вакуумными установками. Им же в 1870 г. изобретён ледяной калориметр — аппарат для измерения количества выделяющегося в процессе реакции тепла. Самым знаменитым из предложенных Бунзеном способов исследования веществ считается метод спектрального анализа, разработанный им в 1854—1859 гг. совместно с немецким физиком Густавом Робертом Кирхгофом (1824—1887). Спектральный анализ позволяет исследовать химический состав далёких звёзд и планет, с помощью этого метода удалось открыть множество химических элементов. В частности, сам Бунзен открыл рубидий и цезий.
Большинство органических реакций сопровождается перераспределением электронной плотности, т. е. являются окислительно-восстановительными. Однако сложность определения степени окисления элементов в органических молекулах заставляет химиков-органиков ввести дополнительные критерии того, является ли процесс окислительно-восстановительным. Под окислением в органической химии понимают процесс присоединения молекулой атомов кислорода или потери водорода, например:
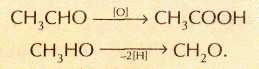
Обратный процесс, приводящий к увеличению числа атомов водорода или потере атомов кислорода, принято называть восстановлением:
Одни из самых распространённых комплексов металлов — карбонилы. Если в комплексе один атом металла, его называют моноядерным. Например, карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4 и т. п. При облучении Fe(CO)5 ультрафиолетовым светом образуется биядерный комплекс Fe2(CO)9, затем триядерный Fe3(CO)12 и т. д. При конденсации карбонилов могут образовываться сложные структуры, содержащие остов из многих атомов металла — Rh6(CO)l6, Os20(CO)2-40 и т. п. Это похоже на «гроздь» связанных друг с другом атомов металлов. Отсюда и название — кластер (англ cluster — «гроздь»). Важнейшая отличительная особенность кластерных — присутствие в них химически связанных друг с другом атомов металлов.
Со времени открытия соли Цейзе были получены олефиновые комплексы для большинства переходных металлов. Олефиновый лиганд, как и очень похожий на него ацетиленовый, являются донорами двух электронов, что и определяет устойчивость таких комплексов.
Обычно олефиновый лиганд достаточно подвижен и легко замещается на другие. Прочность его связи с металлом в большой степени определяется количеством атомов в лиганде, которые связаны с атомом металла. Например, циклопентадиенильный лиганд связан с атомом металла сразу пятью атомами — в элементоорганической химии его называют пентагептолиганд и обозначают h5-С5Н5. Вытеснить такой лиганд из молекулы непросто. Алкены, в том числе и этилен, являются дигепталигандами, т. е. связаны с металлом только двумя атомами углерода.
Органические соединения селена и теллура пользуются дурной славой среди химиков. Для работы со многими из них, в особенности с легколетучими соединениями, требуется специальная техника. Так, в одной из научных публикаций авторы сообщали, что для проведения опытов с алкильными производными селена пришлось построить отдельную лабораторию. И не из-за особой токсичности или взрывоопасности, а из-за запаха! В современной англоязычной научной литературе соединения селена и теллура удостоились эпитетов «зловонный» и «смрадный». Но невзирая на это химики активно работают с такими веществами — на основе органических производных серы и селена получены полимеры с высокой электропроводностью, настоящие «органические металлы»!
Соли типа [TMeTSeF]+BF-4 обладают электропроводностью на уровне обычных металлов. Более того, сопротивление у них при охлаждении падает значительно быстрее, чем у металлов. Учёные надеялись, что температура перехода в сверхпроводящее состояние у них будет достаточно высокой. Однако выяснилось, что при охлаждении до -100 °С сопротивление скачкообразно увеличивается и они становятся изоляторами. Оказалось, что в обычных условиях молекулы «органических металлов» образуют проводящие цепочки. При -100 °С эти цепочки распадаются и проводимость исчезает.
Мышьякорганические соединения вполне могут считаться «патриархами» среди элементоорганических соединений. Их история началась ещё в 1760 г., когда фармацевт французской армии Луи Клод Кадэ (1731— 1799) проводил перегонку ацетата калия с оксидом мышьяка(III). Сейчас уже сложно установить, что было целью того эксперимента. В результате же получилась жидкость с отвратительным чесночным запахом, самовоспламеняющаяся на воздухе. Поскольку это было явно не то, что хотел получить любознательный аптекарь, то исследовать жидкость он не стал.
Про загадочное соединение вспомнили только в следующем веке. Роберт Бунзен, изучая жидкость Кадэ, обнаружил в ней углерод, кислород, водород и мышьяк. В роли «крёстного отца» выступил Якоб Берцелиус, выделивший это вещество в чистом виде. Формула жидкости Кадэ — (CH3)2As—О—As(CH3)2, а название — окись какодила (от греч. «какос» — «дурной» и «одорос» — «запах»).
Если в неорганических соединениях свинец чаще всего двухвалентен, то для элементоорганических более характерна валентность свинца, равная четырём. Тетраэтилсвинец был известен ещё с 1853 г. Длительное время, начиная с 1923 г., он использовался как антидетонатор в моторном топливе (см. статью «Бесценное топливо»).
Это приводило к сильному загрязнению окружающей среды. Кроме того, соединения свинца быстро выводили из строя катализаторы очистки выхлопных газов от оксида углерода. В результате количество фильтров на выхлопной трубе стало резко увеличиваться, а сам автомобиль начал превращаться в химическую лабораторию в миниатюре. Дешевле оказалось получать более дорогой, но в то же время более качественный бензин, чем решать проблемы с очисткой от свинца продуктов сгорания этилированного бензина.
Широкое применение в самых разных областях получили и оловоорганические соединения. В основном они используются как стабилизаторы одного из самых распространённых пластиков — поливинилхлорида. Чистый поливинилхлорид начинает разлагаться и темнеть при 110 °С, тогда как его термическая переработка возможна только при 180 °С. Добавление производных диоктилстаннана типа (C8H17)2Sn(SCH2COOC8H17)2значительно повышает температуру разложения этого полимера, и его обработка становится гораздо легче.
Некоторые оловоорганические соединения довольно токсичны, в отличие от малотоксичных неорганических производных этого металла. Так, весьма ядовиты моно- и тетразамещённые станнаны RSnX3 и R4Sn, но особенно — тризамещённые R3SnX: они блокируют энергообмен в живой клетке. А вот механизм токсического действия дизамещённых станнанов пока не выяснен. Именно токсические свойства тризамещенных станнанов оказались наиболее востребованы. Производные трибутилолова используются как высокоэффективные дезинфицирующие средства.

