Одни из самых распространённых комплексов металлов — карбонилы. Если в комплексе один атом металла, его называют моноядерным. Например, карбонил железа Fe(CO)5, карбонил никеля Ni(CO)4 и т. п. При облучении Fe(CO)5 ультрафиолетовым светом образуется биядерный комплекс Fe2(CO)9, затем триядерный Fe3(CO)12 и т. д. При конденсации карбонилов могут образовываться сложные структуры, содержащие остов из многих атомов металла — Rh6(CO)l6, Os20(CO)2-40 и т. п. Это похоже на «гроздь» связанных друг с другом атомов металлов. Отсюда и название — кластер (англ cluster — «гроздь»). Важнейшая отличительная особенность кластерных — присутствие в них химически связанных друг с другом атомов металлов.
Карбонильную группу в кластерах можно заменить на другие лиганды, например на трифенилфосфин Р(СбН5)3. Да и металлы в одном кластерном ядре могут быть разными —например, железо с медью или кадмием; хром, марганец и вольфрам.
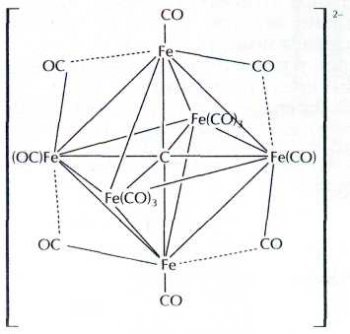
Часто металлический остов представляет собой некий замкнутый объём — куб, бипирамиду, октаэдр. Один из атомов может оказаться внутри этого объёма. Свойства такого «узника» коренным образом меняются. Например, в карбидном кластере железа внутренний атом углерода связан со всеми шестью атомами металла одновременно.
Добраться до этого атома углерода можно, только разрушив кластерное ядро, поэтому обнаружить его присутствие удалось лишь с помощью рентгеноструктурного анализа.
Элементоорганическая химия — пожалуй, единственная область экспериментальной химии, которая сама, практически полностью, создала свой предмет исследований (пока известно всего лишь одно природное соединение, содержащее прямую связь углерод-металл, — одна из форм витамина В12). Реактивы Гриньяра — магнийорганические соединения, например, стали обыденным инструментом химика, а многие другие металлоорганические соединения — промышленными катализаторами.
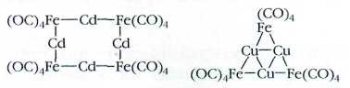
Похожие статьи