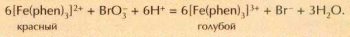В популярных книгах по ботанике описывается такой эксперимент. В широкой части моркови нужно высверлить отверстие вдоль её оси, вставить туда стеклянную трубку с солёной водой, а потом погрузить морковь в дистиллированную воду. Спустя некоторое время можно заметить, что вода в трубке поднялась значительно выше уровня воды в сосуде. Выходит, морковь работает как насос, нагнетая воду в трубку. Явление это называется осмосам (греч. «осмос» — «толчок», «давление») и наблюдается всегда, когда два раствора различной концентрации (или раствор и чистый растворитель) разделены полупроницаемой перегородкой — мембраной. Полупроницаемой она называется потому, что молекулы растворителя через такую мембрану проходят, тогда как растворённое соединение ею задерживается. В результате устанавливается направленный поток молекул растворителя из области, где раствор менее концентрированный (молекул растворителя больше), туда, где раствор более концентрированный (молекул растворителя меньше).
Одно из самых удивительных свойств растворов можно наблюдать зимой на улице: когда слежавшийся снег и лёд посыпают солью, они начинают таять даже в сильный мороз! Происходит это потому, что раствор соли в воде замерзает при более низкой температуре, чем чистая вода. Обычная поваренная соль способна «растопить» лёд при температуре -21,2 °С, а хлорид кальция — при -55 °С
В 1788 г. английский физикохимик и военный врач Чарлз Благден (1748—1820) опубликовал «Опыты над способностью некоторых веществ понижать температуру замерзания воды». Учёный установил, что понижение температуры замерзания DТз раствора не зависит от химической природы растворённого вещества, а зависит только от его концентрации: DTз=Кс, где К — константа замерзания, характерная для данного растворителя, с — концентрация, выраженная в молях растворённого вещества в 1000 г растворителя. Это соотношение выполняется не только для воды, но и для других растворителей, когда концентрация раствора не очень велика. Константа К показывает, на сколько градусов понизится температура замерзания, если в 1000 г растворителя внести 1 моль какого-либо вещества.
«Corpora non agent nisi fluida» — «тела (вещества) не реагируют, если они не растворены». Так считали в древние времена алхимики, и в этом изречении есть значительная доля истины. Если, например, перемешать сухие бесцветные порошки нитрата свинца и иодида калия, никаких видимых изменений не произойдёт. Но стоит добавить к смеси немного воды, моментально появится ярко-жёлтая окраска — это образовался иодид свинца: Pb(NO3)2+2KI=PbI2+2KNO3. Реакция прошла лишь после того, как исходные вещества растворились в воде. Другой общеизвестный пример — «сухой лимонад», смесь бикарбоната натрия (питьевой соды), тонко растёртой лимонной кислоты, сахара и красителя. Как только порошок высыпают в стакан с водой, сразу идёт бурная реакция лимонной кислоты с содой: С6Н8О7+2NaHCO3=Na2C6H6O7+2H2O+2СО2. Выделяющийся углекислый газ делает напиток газированным.

Всем, кто пьёт сладкий чай, известно, какой замечательной растворимостью в горячей воде обладает сахар.
Конструкторы первых космических кораблей и подводных лодок столкнулись с проблемой: как поддерживать на судне или космической станции постоянный состав воздуха, т. е. как избавиться от избытка углекислого газа и возобновить запас кислорода? Решение было найдено изящное: надо превратить СО2 в О2 Это можно сделать, например, с помощью надпероксида калия КО2, который образуется при сгорании калия в кислороде. В реакции с СО2 часть кислорода, содержащегося в КО2, выделяется в свободном виде, а СО2 связывается в карбонат калия: КО2+СО2 ®К2СО3+О2.
В космической экспедиции на счету каждый грамм груза. Чтобы рассчитать минимально необходимый запас надпероксида, нужно установить, в каком соотношении реагируют КО2 и СО2. Для этого используем метод электронного баланса.
Химия — наука количественная. Коэффициенты в уравнениях окислительно-восстановительных реакций позволяют определить, в каких пропорциях нужно смешать исходные вещества, чтобы процесс пошёл в правильном направлении, а также рассчитать количество конечных продуктов.
В окислительно-восстановительных реакциях число отданных электронов всегда равно числу принятых. Кроме того, соблюдается материальный баланс, т. е. число атомов каждого элемента должно быть одинаковым в левой и правой части уравнения. Поэтому чтобы найти коэффициенты для уравнения окислительно-восстановительной реакции, поступают следующим образом. Сначала реакцию разбивают на полуреакции окисления и восстановления, записывают уравнения этих процессов определяют число электронов, отданных восстановителем и принятых окислителем. Затем уравнения полуреакций умножают на такие коэффициенты, чтобы число отданных электронов было равно числу принятых. Наконец, полуреакции складывают и получают суммарное уравнение реакции.
Уравнения полуреакций можно составить по-разному. По одному из методов — методу электронного баланса — элемент-окислитель и элемент-восстановитель записывают в виде атомов с определённой степенью окисления, и число электронов находят как разность зарядов в левой и правой части полуреакции.
С декабря 1997 г. самый известный журнал, посвящённый химическому образованию, «Journal of Chemical Education», перестал публиковать статьи о способах подбора коэффициентов в реакциях. Его главный редактор Джон Мур, университетский профессор химии в городе Мэдисон (штат Висконсин), объяснил столь строгое решение тем, что самому ему приходилось подбирать «трудные» коэффициенты только по заданию преподавателей, когда он был первокурсником, тогда как для его многолетней профессиональной деятельности как химика-исследователя это практически никогда не требовалось. Более того, редактор уверен, что в трудных случаях подбор коэффициентов лучше поручить компьютеру: самая простенькая программа сделает всё, что надо, лучше химика и за доли секунды. И вот здесь уважаемый профессор ошибся!
Оказывается, компьютерные программы заботятся лишь о том, чтобы сохранялся материальный баланс по каждому из элементов, и совершенно равнодушны к тому, имеют ли найденные коэффициенты какой-либо химический смысл. В качестве типичного примера можно привести следующее уравнение реакции, опубликованное в упомянутом американском журнале: 88Н2+12BrCl+6РbСrO4+6Na[AlF4+6KI+3MgSiO3+2H3PO4+10FeSO4+20SO2+15Ca(CN)2+3CF2Cl2=15CaF2+6K[Al(OH)4]+3MgCO3+3Na2SiO3+2PI3+10Fe(SCN)3+6PbBr2+6CrCl3+70H2O.
Направление многих окислительно-восстановительных реакций зависит от кислотности среды. Примером может служить взаимодействие бромат-ионов BrO-3 с ферроином — комплексом железа(II) с органическим соединением 1,10-фенантролином (phen). В сильнокислой среде бромат-ион окисляет ферроин, и свойственная его растворам красная окраска сменяется голубой, характерной для комплекса железа(III). При подщелачивании голубого раствора железа(III) оно восстанавливается бромид-ионами в железо(Н), и красная окраска ферроина возвращается:
Точно предсказать продукты неисследованной реакции во многих случаях не в состоянии ни один химик. Их определяют экспериментально.
А затем уже предлагают возможный механизм реакции и объясняют, почему образуются именно эти продукты.
Отличие современной химии от средневековой состоит в том, что появились надёжные теории, которые позволяют с большой долей вероятности предсказывать продукты новых реакций и вести целенаправленный синтез веществ. Разработаны они и для процессов окисления-восстановления. Сами по себе эти теории довольно сложные, но существует несколько простых рецептов, пользуясь которыми, даже начинающий химик сможет предвидеть результаты многих окислительно-восстановительных реакций.
Для этого нужно знать важнейшие окислители и восстановители, представлять их относительную окислительную и восстановительную способность, помнить наиболее распространённые степени окисления элементов в соединениях и понимать, в виде каких ионов или молекул эти вещества существуют в той или иной среде.
Самый распространённый на Земле окислитель — кислород. Намного более сильным окислителем является озон О3 — аллотропная модификация кислорода. Он способен окислять многие вещества, которые с кислородом при обычных условиях не реагируют, например оксид азота(1\/): 2NO2+О3= N2O5+O2 и серебро: 2Ag+2О3=Ag2O2+2О2.
Наиболее сильный окислитель из числа простых веществ — фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и характера среды. Кроме него применяют также дихромат калия К2Сг2О7, азотную кислоту HNO3, пероксид водорода Н2О2, хлор С12, гипохлорит натрия NaClO. Очень сильные окислители — фториды благородных газов. Самый сильный из известных окислителей — фторид кислорода OF2.
Из восстановителей наиболее распространённый в природе — углерод. Его широко используют в промышленности для получения металлов из оксидов: Fe2O3+3С=2Fe+3СО; ZnO+С=Zn+CO.
Первую химическую реакцию человек провёл тогда, когда научился добывать огонь. С той поры и до настоящего времени реакции горения играют первостепенную роль в нашей жизни. Они приносят в дома тепло, двигают автомобили, самолёты и ракеты, помогают извлекать ценные вещества из природного сырья.
Флогистонная теория Шталя впервые выделила процессы горения и прокаливания металлов в отдельную группу реакций (см. статью «Химия в XVIII веке»). Кислородная теория горения, предложенная Лавуазье, обобщила экспериментальный материал, накопленный в «эпоху флогистона». А кроме того, Лавуазье выдвинул кислородную теорию кислот: он полагал, что своими свойствами кислоты обязаны присутствию в них кислорода (отсюда и название элемента oxygenium — «рождающий кислоты»). Поэтому реакции горения веществ на воздухе стали называть окислением, а
процессы, обратные окислению, т. е. связанные с уменьшением количества кислорода в веществе, — раскислением или восстановлением. Поскольку в ходе окислительных реакций вещество нередко разрушается (как, например, при ржавлении), термин «восстановление» указывает на процесс, противоположный окислению.
В дальнейшем представления о сущности процесса окисления значительно расширились. Как показали эксперименты, многие вещества (водород, металлы) горят не только в кислороде, но и в хлоре, броме. А значит, окисление — это не только присоединение кислорода. В 1914 г. русский учёный Лев Владимирович Писаржевский (1874—1938) предложил электронно-ионную теорию окислительно-восстановительных реакций.
В наши дни химикам известны тысячи самых разных окислительно-восстановительных реакций, в том числе и протекающих в живых организмах. Можно с уверенностью говорить: химия жизни — это процессы окисления-восстановления.
Обычно считается, что измельчение вещества — физический процесс. Однако это не совсем так. При длительной обработке в специальных мельницах частицы вещества за счёт поглощения энергии переходят в химически активное состояние: усиливаются колебательные движения атомов, молекул и ионов в узлах кристаллической решётки, ослабляются связи между ними, рвутся некоторые связи, возникают свободные радикалы.
Простейшие химические реакции обычно подразделяют на четыре типа: реакции соединения, разложения, замещения и обмена. Д. И. Менделеев определял соединение как реакцию, «при которой из двух веществ происходит одно, или, вообще, из данного числа — меньшее их число». Например, при нагревании порошков железа и серы образуется сульфид железа: Fe+S=FeS. К реакциям соединения относят процессы горения простых веществ (серы, фосфора, углерода) на воздухе: С+О2=СО2. Они всегда сопровождаются выделением тепла — являются экзотермическими (см. статью «Тепло химических реакций»).
Реакции разложения, по Менделееву, «составляют случаи, обратные соединению, то есть такие, при которых одно вещество даёт два, или, вообще, данное число веществ — большее их число. Так, при накаливании дерева (без доступа воздуха. — Прим. ред.) получается горючий газ, водянистая жидкость, смола или дёготь и уголь». Более простой пример — разложение известняка: СаСО3=СаО+СО2. Для проведения реакции разложения, как правило, требуется нагревание. Такие процессы — эндотермические, т. е. протекают с поглощением теплоты.
В реакциях двух других типов число реагентов равно числу продуктов (Менделеев называл их реакциями перемещения). Если взаимодействуют простое вещество и сложное — это реакция замещения: Fe+CuSO4= FeSO4+Cu.