Конструкторы первых космических кораблей и подводных лодок столкнулись с проблемой: как поддерживать на судне или космической станции постоянный состав воздуха, т. е. как избавиться от избытка углекислого газа и возобновить запас кислорода? Решение было найдено изящное: надо превратить СО2 в О2 Это можно сделать, например, с помощью надпероксида калия КО2, который образуется при сгорании калия в кислороде. В реакции с СО2 часть кислорода, содержащегося в КО2, выделяется в свободном виде, а СО2 связывается в карбонат калия: КО2+СО2 ®К2СО3+О2.
В космической экспедиции на счету каждый грамм груза. Чтобы рассчитать минимально необходимый запас надпероксида, нужно установить, в каком соотношении реагируют КО2 и СО2. Для этого используем метод электронного баланса.
Окислителем и одновременно восстановителем является кислород в составе надпероксида калия (степень окисления кислорода здесь -1/2). Такие реакции, в которых окислителем и восстановителем выступает один и тот же элемент называют реакциями диспропорционирования. Продукт реакции содержит два атома О0, поэтому полуреакцию окисления лучше всего записать в виде: 2О-1/2®О2. Заряд левой части уравнения равен -1, заряд правой части 0. Теперь уравниваем заряды: 2О-1/2-е®О2.
Полуреакция восстановления: 2О-1/2®2О-2. Для того чтобы из заряда -1 получить заряд-4, окислитель должен принять три электрона: 2O-1/2+3е®2O-2.
Чтобы уравнять число отданных и принятых электронов, первое уравнение надо умножить на 3:
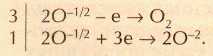
Складывая две полуреакции, получаем: 8О-1/2 ®3О2+2O-2. Учитывая расход восьми атомов кислорода, надо перед КО2 поставить коэффициент 4: 4КО2+СО2®К2СО3+3О2. Осталось уравнять число атомов К и С. Окончательное уравнение реакции: 4КО2+2СО2 = 2К2СО3+3О2.
С помощью этого уравнения можно вычислить, что для связывания 1 кг (0,51 м3) углекислого газа — а именно столько выдыхает человек за сутки — расходуется 3,2 кгKО2 и при этом выделяется 1,1 кг (0,77 м3) кислорода.
Жёлтый порошок КО2 при взаимодействии с углекислым газом превращается в белый порошок К2СО3


Похожие статьи