Самый распространённый на Земле окислитель — кислород. Намного более сильным окислителем является озон О3 — аллотропная модификация кислорода. Он способен окислять многие вещества, которые с кислородом при обычных условиях не реагируют, например оксид азота(1\/): 2NO2+О3= N2O5+O2 и серебро: 2Ag+2О3=Ag2O2+2О2.
Наиболее сильный окислитель из числа простых веществ — фтор. Но он слишком активен, и его трудно получить в свободном виде. Поэтому в лабораториях в качестве окислителя используют перманганат калия KMnO4. Его окислительная способность зависит от концентрации раствора, температуры и характера среды. Кроме него применяют также дихромат калия К2Сг2О7, азотную кислоту HNO3, пероксид водорода Н2О2, хлор С12, гипохлорит натрия NaClO. Очень сильные окислители — фториды благородных газов. Самый сильный из известных окислителей — фторид кислорода OF2.
Из восстановителей наиболее распространённый в природе — углерод. Его широко используют в промышленности для получения металлов из оксидов: Fe2O3+3С=2Fe+3СО; ZnO+С=Zn+CO.
Другой широко распространённый восстановитель — водород. Как и углерод, при нагревании он лег-
ко отнимает атомы кислорода у многих оксидов, превращаясь при этом в воду: СuО+Н2=Сu+Н2О; WO3+ЗН2=W+ЗН2О.
Очень сильными восстановителями являются щелочные и щёлочно-земельные металлы, алюминий. Они восстанавливают даже воду, вытесняя из неё водород: 2Na+2Н2О=2NaOH+Н2.
На практике восстановительными свойствами металлов пользуются для получения некоторых активных металлов из их оксидов и хлоридов. Так получают барий: ЗВаО+2Al=ЗВа+Аl2О3, стронций: 3SrO+2Al=3Sr + Al2O3, титан: TiCl4+2Mg=Ti+2MgCl2.
В лабораторных условиях восстановителями служат соединения, содержащие элементы в низких степенях окисления: сероводород H2S (S-2), иодоводородная кислота HI (I-), хлорид олова(II) SnCl2 (Sn+2). В органическом синтезе для восстановления обычно используют комплексные гидриды металлов: алюмогидрид лития LiAlH4 и борогидрид натрия NaBH4; они содержат водород в степени окисления -1.
Самый слабый восстановитель— фторид-ион F-. Окислить его до свободного фтора можно только с помощью электролиза или экзотических окислителей. Это объясняется с помощью теории сопряжённых окислителей и восстановителей.
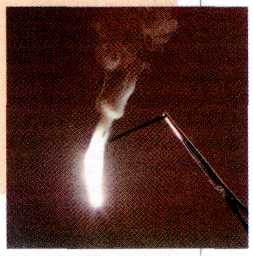
При горении магниевой ленты на воздухе электроны от атомов магния переходят к атомам кислорода: 2Mg+О2=2MgO.
Похожие статьи